4 группы делятся: Периодическая таблица — урок. Химия, 8 класс.
Содержание
На какие виды и группы делятся ткани
Жизнь человека невозможно представить без тканей. До их изобретения люди защищали свое тело шкурами животных, спали на них, ими же утепляли свое жилище. Чтобы получать полотно большого размера, их сшивали сухожилиями. По мнению ученых, первым сырьем для получения ткани были сухие стебли трав. Именно их начали переплетать между собой и таким образом получали полотно, которое шло на изготовление одежды, покрывал. Чуть позже люди научились прясть из шерсти домашних животных и использовать нити шелка.
Первые ткацкие станки также появились в древности. На египетских фресках запечатлены простейшие из них. В 1785 году был запатентован первый механический станок с ножным приводом. Это изобретение не заменило ручного ткачества, но вывело производство тканей на новый уровень. До конца XIX века вся материя была натуральной. Ее делали из шерсти животных, хлопка, шелковых нитей. Но с развитием промышленности начали появляться искусственные и синтетические ткани.
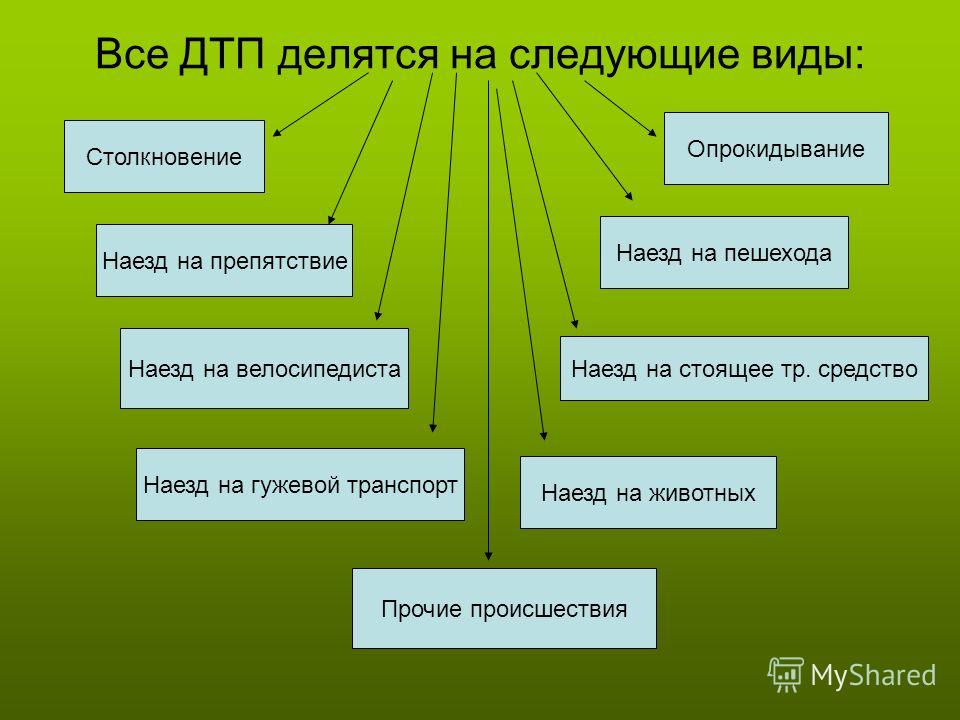
По каким критериям разделяют ткани
Полотна – это переплетенные перпендикулярно между собой нити. Таким образом все ткани делятся по способу плетения и сырью. Кроме того, есть разделение по назначению, сезону и отделке. В нашем магазине можно купить ткань в розницу для любых бытовых целей с доставкой по всей России и странам СНГ.
Группы по виду сырья
Всего есть 4 вида тканей.
- Натуральные. Их делают из нитей животного, растительного или минерального происхождения. Самые известные из них: хлопок, лен, шелк и шерсть.
- Искусственные. Для их производства также используют натуральное сырье, например целлюлозу. Такие ткани – результат тщательной переработки природных материалов. После изобретения искусственные волокна добавляли к натуральным, чтобы сделать исходный продукт дешевле. И как следствие появилась еще одна группа тканей.
- Смешанные. Их получают путем комбинации нескольких видов сырья. Это позволяет улучшить качество тканей. Кроме того, благодаря этому были созданы новые виды материй, например гипюр, жаккард, тюль и другие.
- Синтетические. Их появление – это заслуга химической промышленности. Производство синтетики началось примерно в середине XX века. Синтетические волокна – это расплавленные полимеры, из которых делали тонкие длинные нити. Самой первой тканью, полученной таким способом, является нейлон.
Каждый из видов востребован для производства различных вещей, как для повседневного использования, так и для специального. Например, из синтетических тканей не шьют постельное белье, но вот парашют из шелка или вискозы также не встретишь. Т. е. для каждого из видов есть своя ниша.
Виды плетения
Ткацкий станок переплетает нити в нескольких плоскостях. Нити основы располагаются вертикально, а нити утка – по горизонтали. Именно вид переплетения определяет то, как будет выглядеть ткань, какими свойствами она будет обладать. Переплетение делится на 4 класса: главное, мелкоузорчатое, сложное, крупноузорчатое. Они в свою очередь делятся еще на несколько подгрупп.
Главное переплетение может быть полотняным, саржевым, атласным, сатиновым. Отличаются они разным количеством перекрытий нитей утка и основы.
Отличаются они разным количеством перекрытий нитей утка и основы.
Остальные классы – это производные от главного переплетения. Они отличаются количественным соотношением нитей основы и утка.
Виды тканей по назначению
Как уже было сказано выше, ткани различаются не только видом производства и сырьем, но и назначением. Выделяют такие группы:
- постельные;
- для домашнего текстиля;
- пальтовые;
- мебельные;
- текстиль для верхней одежды;
- декоративные;
- плащевые и др.
В отдельную группу можно отнести техническую ткань, которую используют для пошива защитной одежды, производства тентов, парусины и много другого.
Читайте далее статью об однотонных постельных тканях.
Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
Периодическая таблица химических элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода.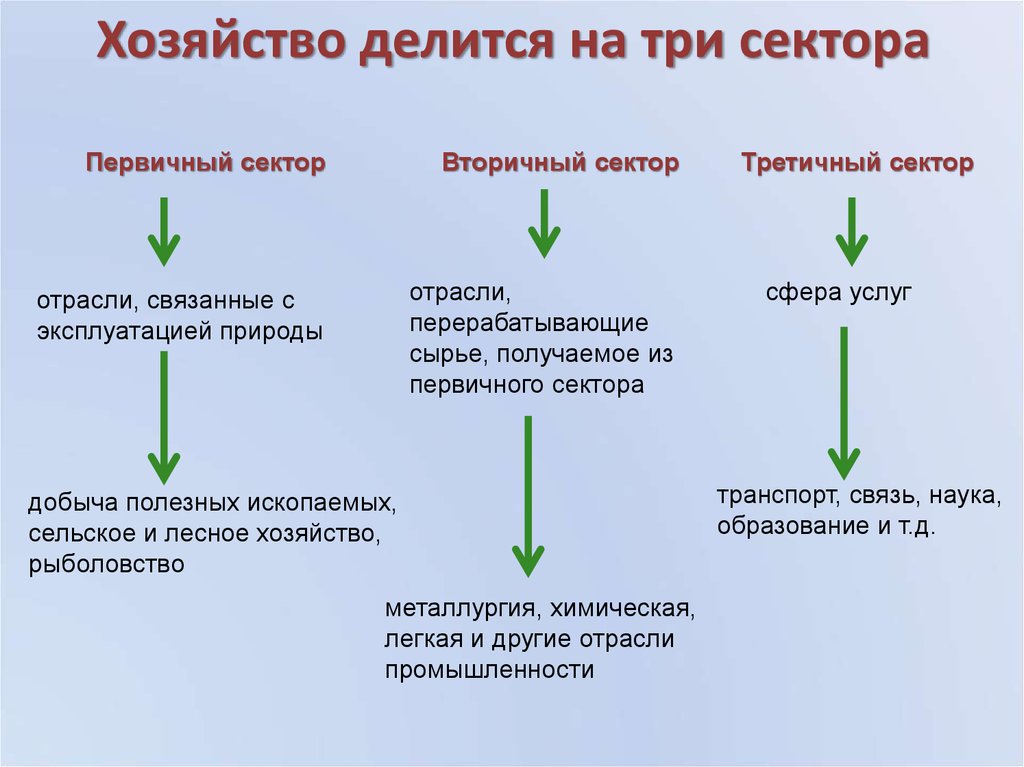 Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду
CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.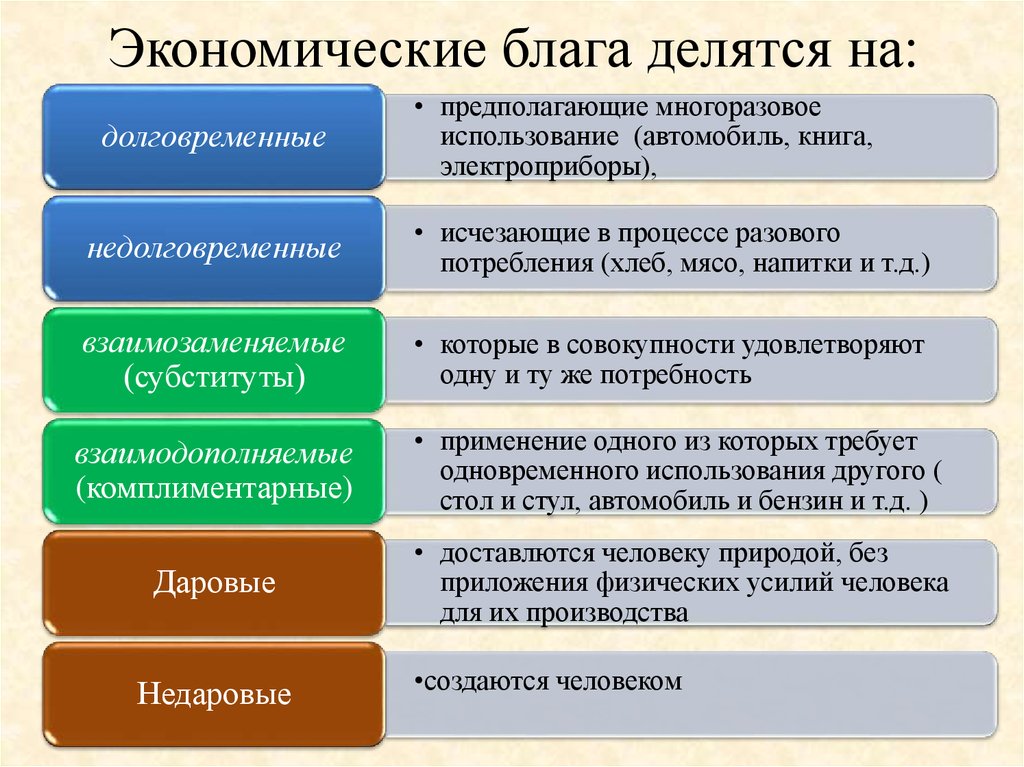
Базовая математика | Раздел Объяснение
Поиск по моему сайту:
Поделись этой страницей!
Деление как многократное вычитание
Деление является обратным умножению.
При умножении мы хотим узнать сумму групп чисел .
В приведенном ниже примере мы хотим узнать сумму 4 групп по 8 .
При делении мы хотим разделить сумму на несколько групп и узнать, сколько в каждой группе.
В приведенном ниже примере мы хотим узнать, сколько человек в каждой группе, если мы разделим 72 на 4 равные группы?
(Часть 2) Подробнее о разделе
Словарь раздела
Раздел с остатком
Длинный раздел
Посмотрите видео с обзором отдела.
Деление также можно объяснить следующим образом: мы хотим разделить сумму на группы определенного числа, и мы хотим знать, сколько групп существует.
В приведенном ниже примере мы хотим узнать, сколько групп по 4 можно получить из 36?
Распечатайте и вырежьте эти карточки.
Содержание
Разделить на равные группы
Вот как вы научите своего ребенка делить число на равные группы.
Разделим 12 на 3 равные группы. Сколько в каждой группе?
Дайте ребенку 12 фишек (для иллюстрации я буду использовать ракушки) и разделите их следующим образом:
- Начните с 12.
(Выстраивать их не обязательно.)
2. Возьмите одну часть и отложите ее в сторону.
3. Возьмите еще один кусок и положите его во вторую стопку.
4. Возьмите следующий кусок и положите его в третью стопку.
Теперь у нас есть 3 стопки или группы.
5. Положите четвертую часть обратно в первую стопку.
Продолжайте помещать фишку в каждую группу, пока не будут израсходованы все 12 жетонов.
В итоге у вас будет 4 счетчика в каждой группе, поэтому 12 разделить на 3 равно 4.
Запишите это так: 12 ÷ 3 = 4
Содержание
Разделите число на группы
Вот другой способ деления.
Разделите 12 на группы по 3 человека. Сколько групп я получу? Другими словами, сколько троек входит в число 12?
Дайте ребенку 12 фишек и разделите их следующим образом:
1. Начните с 12.
2. Сгруппируйте их по три.
Вы получите 4 группы.
Опять же, 12, деленное на 3, равно 4. Или 4 группы по 3 входят в 12.
Запишите это так: 12 ÷ 3 = 4
Деление как многократное вычитание
повторное вычитание.
Например, 12 ÷ 4 означает, сколько раз можно вычесть 4 из 12?
Резюме
Подробнее о Дивизионе
Словарь Дивизиона
Деление с остатком
Длинное деление
Множители, наибольший общий множитель
Игра в деление
Вот несколько карточек с заданиями на деление, в которые можно поиграть с ребенком. Распечатайте и вырежьте эти карточки. Держите под рукой набор жетонов, которыми может пользоваться ваш ребенок.
Распечатайте и вырежьте эти карточки. Держите под рукой набор жетонов, которыми может пользоваться ваш ребенок.
Перемешайте карты и положите их стопкой лицевой стороной вниз в центре стола.
Откройте верхнюю карту. Каждый пишет свою работу. Затем по очереди объясните, как они получили ответ.
Используйте различные методы, показанные выше, чтобы ваш ребенок понял, что есть много способов найти ответ на вопрос.
Правила делимости
Если вы хотите узнать, можно ли разделить одно число на другое число, вы можете применить некоторые правила делимости. То есть есть несколько коротких путей, чтобы узнать, можно ли разделить число на 2, 3, 4 и так далее.
Вот некоторые из этих правил.
Другие темы
Множители и множители
Длинное деление
Забавная математика
Содержание
вероятность — разделение людей на группы по 4 человека
спросил
Изменено
2 года, 8 месяцев назад
Просмотрено
258 раз
$\begingroup$
$\textbf{Q1: }$ Класс, состоящий из 4 выпускников и 12 студентов старших курсов, случайным образом делится на четыре группы по 4 человека в каждой. Какова вероятность того, что в каждой группе есть аспирант?
Какова вероятность того, что в каждой группе есть аспирант?
Моя попытка: $$P = \frac{ \left( \binom{4}{1}\binom{12}{3}\right) \left( \binom{3}{1}\binom{9} {3}\справа)\влево(\бином{2}{1}\бином{6}{3}\право)\влево( \бином{1}{1}\бином{3}{3}\право) }{\binom{16}{4}\binom{12}{4}\binom{8}{4}\binom{4}{4}}$$
$\textbf{Q2: }$ Тот же вопрос, что и выше, но с $n$ аспирантами и $16-n$ старшекурсниками, какова вероятность того, что в каждой группе есть аспирант? Конечно, $n\geq 4$?
Моя попытка:
$$P = \frac{ \text{something} }{\binom{16}{4}\binom{12}{4}\binom{8}{4}\binom{4} {4}} $$
$$\text{что-то} = \underbrace{\left(\binom{n}{1}\binom{n — 1}{1}\binom{n-2}{1} \binom{n-3}{1} \right)}_{(\text{T1})} \, \, \underbrace{\binom{12}{3}\binom{9}{3}\binom{ 6}{3}\binom{3}{3}}_{(\text{T2})}$$
, где $\text{T1}$, я думаю, сначала назначает каждого аспиранта каждой группе и $\text {T2}$ назначает всех остальных.
Пожалуйста, дайте мне знать, если это имеет смысл.
Спасибо.
- вероятность
- комбинаторика
$\endgroup$
1
$\begingroup$
Допустим, преподаватель не может отличить аспирантов от студентов бакалавриата, поэтому он просто делит всех на группы по $4$. Определите $A_{i}$ как «в группе $i$ нет аспирантов».
$$
P (A_ {i}) = \ frac {\ binom {12} {n}} {\ binom {16} {n}}
$$
Поскольку, если в группе нет ни одного аспиранта, то все $n$ аспирантов находятся среди $12$ студентов, не входящих в эту группу, а не среди всех $16$ студентов.
Аналогично,
$$
\begin{выровнено}
P (A_ {i} \ cap A_ {j}) & = \ frac {\ binom {8} {n}} {\ binom {16} {n}} \\
\\
P(A_{i}\cap A_{j}\cap A_{k})&=\frac{\binom{4}{n}}{\binom{16}{n}}\\
\\
P(A_{i}\cap A_{j}\cap A_{k}\cap A_{l})&=\frac{\binom{0}{n}}{\binom{16}{n}}= 0
\end{выровнено}
$$
Теперь воспользуемся принципом включения-исключения, чтобы найти вероятность того, что хотя бы в одной группе нет ни одного аспиранта.

Всего комментариев: 0