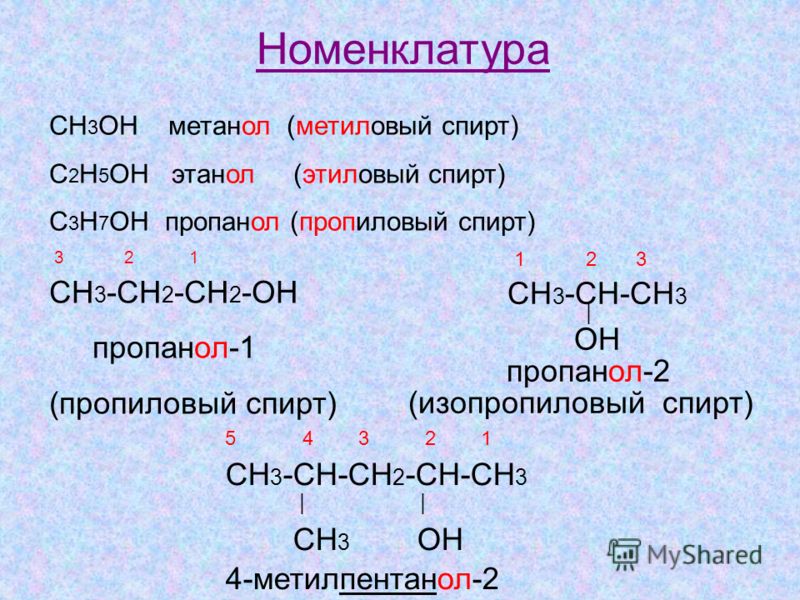
Ch3 это что: CH3-CH2-CH3 дать название — ответ на Uchi.ru
Содержание
Acetyl
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Амины — что это? | Химтраст
-
О компании- О компании
- Дилерская политика
- Вакансии
- Новости
- Отзывы
- Сертификаты
- Благотворительность
- Специальная оценка условий труда
-
Каталог -
Скидки -
Покупателям- Калькулятор
- Каталог подрядчиков
- Скидочная программа
- Правила оплаты
- Контакты дилеров
-
Услуги- Теплоизоляция
- Гидроизоляция
- Огнезащита
- Укладка резиновой крошки
- Заливка наливных полов
- Фотоотчеты
-
База знаний- Статьи
- Альбом решений
- Видео
- Вопросы и ответы
- Энциклопедия
-
Обучение -
Контакты
-
-
Каталог
Калькулятор напылёнщика
Рассчитайте толщину напыления и объем компонентов ППУ
перейти к калькулятору
Аминами называются органические производные аммиака, в котором один, два или все три атома водорода замещены на углеводородные радикалы (предельные, непредельные, ароматические). Название аминов производят от названия углеводородного радикала с добавлением окончания –амин или от названия соответствующего углеводорода с приставкой амино-.
Название аминов производят от названия углеводородного радикала с добавлением окончания –амин или от названия соответствующего углеводорода с приставкой амино-.
Примеры:
-
Ch4 – Nh3 — метиламин; - Ch4 – NH – C2H5 — метилэтиламин.
фениламин (анилин)
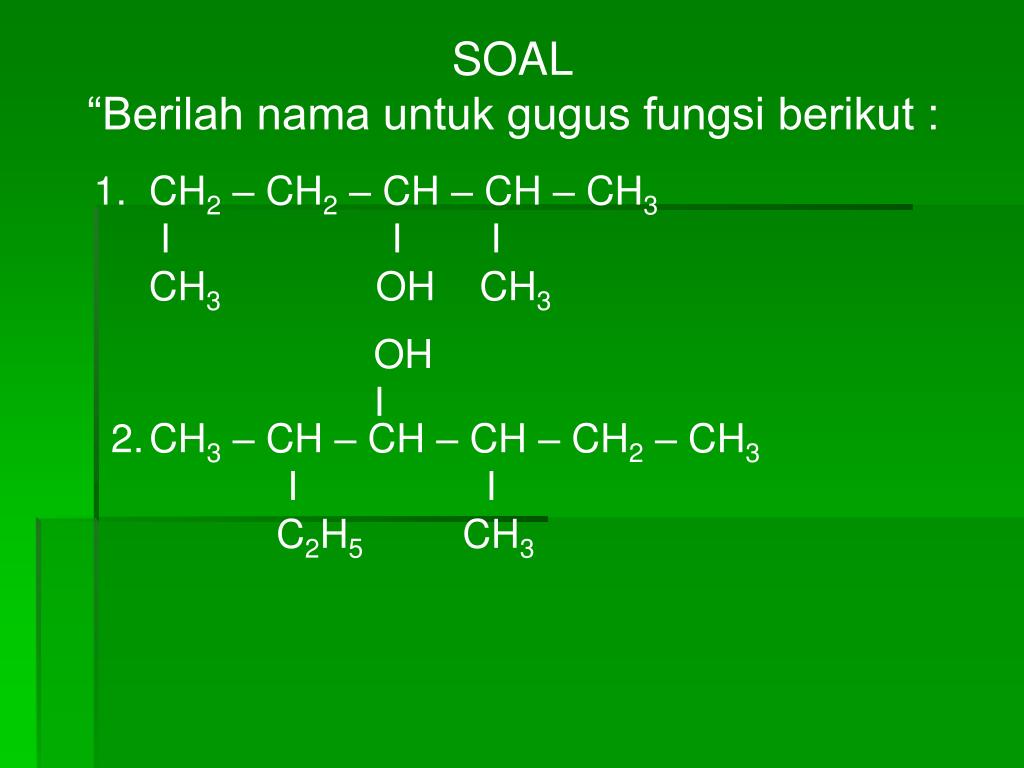
В зависимости от числа атомов водорода, замещенных в аммиаке на углеводородные радикалы, различают первичные, вторичные и третичные амины:
- первичный амин: R – Nh3
- вторичный амин: R – NH – R’
- третичный амин: R – N – R”
Где R, R’, R’’ – углеводородные радикалы.
Первичные, вторичные и третичные амины можно получить, проводя алкилирование (введение алкильного радикала) аммиака. При этом происходит постепенное замещение атомов водорода аммиака на радикалы, и образуется смесь аминов:
-
Nh4 + Ch4I — Ch4Nh3 + HI -
Ch4Nh3 + Ch4I — (Ch4)2NH + HI -
(Ch4)2NH + Ch4I — (Ch4)2N + HI
Обычно в смеси аминов преобладает один из них в зависимости от соотношения исходных веществ.
Для получения вторичных и третичных аминов можно использовать реакцию аминов с галогеналкилами:
(Ch4)2NH + C2H5Br — (Ch4)2NC2H5 + HBr
Амины можно получить восстановлением нитросоединений. Обычно нитросоединения подвергают каталитическому гидрированию водородом:
C2H5NO2 + 3h3 — C2H5Nh3 + 2h3O
Этот метод используется в промышленности для получения ароматических аминов.
Предельные амины. При обычных условиях метил амин Ch4Nh3, диметиламин (Ch4)2NH, триметиламин (Ch4)3N и этиламин C2H5Nh3 – газы с запахом, напоминающим запах аммиака. Эти амины хорошо растворимы в воде. Более сложные амины – жидкости, высшие амины – твердые вещества.
Для аминов характерны реакции присоединения, в результате которых образуются алкиламиновые соли. Например, амины присоединяют галогеноводороды:
(Ch4)2Nh3 +HCl — [(Ch4)2Nh4]Cl
хлорид этиламмония
(Ch4)2NH + HBr — [(Ch4)2Nh3]Br
бромид диметиламмония
(Ch4)3N + HI — [(Ch4)3NH]I
иодид триметиламмония
Тритичные амины присоединяют галогенопроизводные углеводорода с образованием тетраалкиламмониевых солей, например:
(C2H5)3N + C2H5I — [(C2H5)4N]I
Алкиламониевые соли растворимы в воде и в некоторых органических растворителях.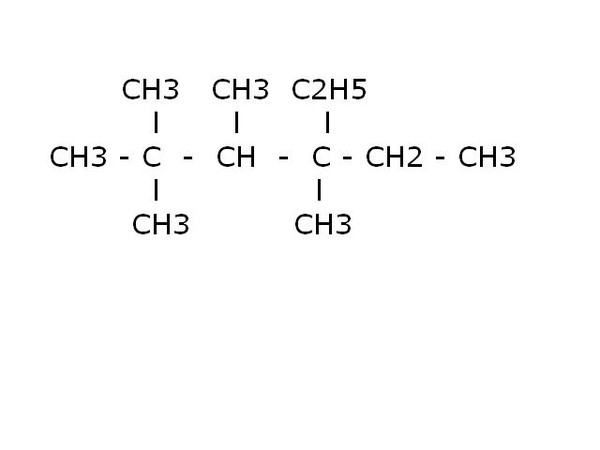 При этом они диссоциируют на ионы:
При этом они диссоциируют на ионы:
[(C2H5)4N]I === [(C2H5)4N]+ + I-
В результате водные и неводные растворы этих солей проводят электрический ток. Химическая связь в алкиламмониевых соединениях ковалентная, образованная по донорно-акцепторному механизму:
Ион метиламмония
Углеводороды
Углеводороды
Углеводороды
Органические молекулы:
Органическая химия изучает свойства соединений углерода. Все соединения углерода, за исключением нескольких неорганических соединений углерода, являются органическими. Неорганические соединения углерода включают оксиды углерода, бикарбонаты и карбонаты ионов металлов, цианиды металлов и некоторые другие.
Углеводороды
Простейшие органические соединения состоят только из атомов углерода и водорода. Соединения только углерода и водорода называются Углеводороды .
Алканы
Простейший углеводород – метан, CH 4 . Это простейший член ряда углеводородов. Каждый последующий член ряда имеет на один атом углерода больше, чем предыдущий член. Этот ряд соединений называется алканов ( С n H 2n+2 ) . Более легкие газы и используются в качестве топлива. Средние (от 7 углеродов до 12 углеродов) — это жидкости, используемые в бензине (бензине). Высшие представляют собой воскообразные твердые вещества. Свечной воск представляет собой смесь алканов. Алканы являются насыщенными, что означает, что они содержат максимальное количество атомов водорода на углерод и не содержат двойных или тройных связей.
Это простейший член ряда углеводородов. Каждый последующий член ряда имеет на один атом углерода больше, чем предыдущий член. Этот ряд соединений называется алканов ( С n H 2n+2 ) . Более легкие газы и используются в качестве топлива. Средние (от 7 углеродов до 12 углеродов) — это жидкости, используемые в бензине (бензине). Высшие представляют собой воскообразные твердые вещества. Свечной воск представляет собой смесь алканов. Алканы являются насыщенными, что означает, что они содержат максимальное количество атомов водорода на углерод и не содержат двойных или тройных связей.
Наименование органических соединений относится к органической номенклатуре . Существует множество правил именования органических соединений, систематизированных Международным союзом теоретической и прикладной химии 9.0003
Правила ИЮПАК для номенклатуры алканов
1. Найдите и назовите самую длинную непрерывную углеродную цепь.
Найдите и назовите самую длинную непрерывную углеродную цепь.
2. Определите и назовите группы, присоединенные к этой цепочке.
3. Последовательно пронумеруйте цепь, начиная с конца, ближайшего к группе заместителей.
4. Обозначьте расположение каждой группы заместителей соответствующим номером и названием.
5. Соберите название, перечислив группы в алфавитном порядке.
Приставки ди, три, тетра и т. д., используемые для обозначения нескольких однородных групп, при алфавитном алфавите не учитываются.
Количество атомов углерода | Префикс | Структура |
1 | Мет ан | CH 4 |
2 | Эт ан | CH 3 CH 3 |
3 | Опора ан | CH 3 CH 2 CH 3 |
4 | Бут ане | CH 3 (CH 2 ) 2 CH 3 |
5 | Пент ан | CH 3 (CH 2 ) 3 CH 3 |
6 | Шестигранник Ане | Ч 3 (CH 2 ) 4 CH 3 |
7 | Гепт ане | CH 3 (CH 2 ) 5 CH 3 |
8 | октябрь ан | CH 3 (CH 2 ) 6 CH 3 |
9 | Не ан | CH 3 (CH 2 ) 7 CH 3 |
10 | декабрь ан | CH 3 (CH 2 ) 8 CH 3 |
11 | Ундец ан | CH 3 (CH 2 ) 9 CH 3 |
12 | Додек ане | CH 3 (CH 2 ) 10 CH 3 |
Изомерия
Все алканы с 4 и более атомами углерода проявляют структурную изомерию .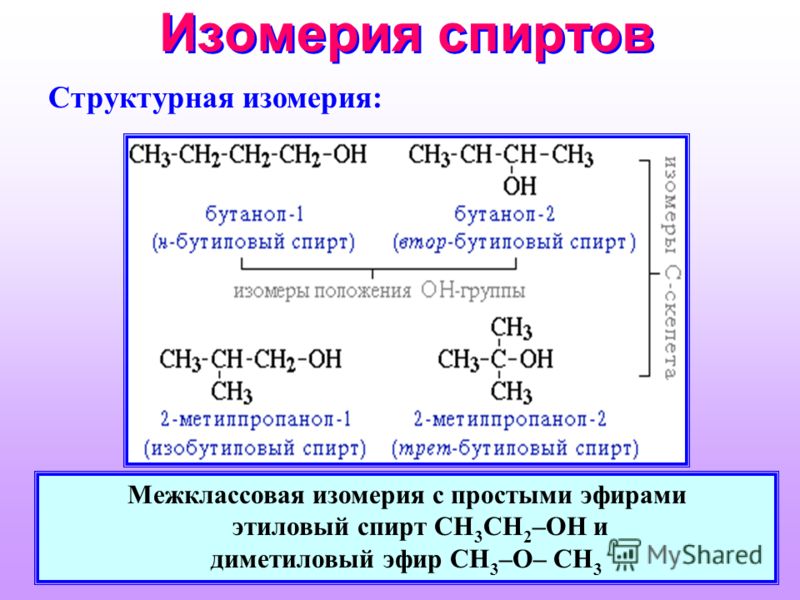 Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул.
Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул.
Например, C 4 H 10 может быть любой из этих двух разных молекул:
Они называются соответственно бутан и 2-метилпропан .
Наименование структурных изомеров алканов
Номенклатура усложняется, если алкан разветвляется. В таком случае есть несколько правил, которым вы должны следовать, чтобы дать алкану правильное название.
- Найдите самую длинную углеродную цепь в молекуле. Количество атомов углерода в самой длинной цепи становится родительским именем (см. таблицу выше)
- Найдя исходную цепь, вы нумеруете исходную цепь, начиная с конца, ближайшего к первому заместителю (заместителем является любой фрагмент, выступающий за пределы основной цепи).
- Далее определите названия всех заместителей . Заместители называются так, как если бы часть была отдельной молекулой, за исключением того, что используется суффикс yl, а не ane. Таким образом, двухуглеродный заместитель будет этильным заместителем (а не этановым заместителем).
- Поместите заместители в алфавитном порядке (т.е. этил перед метилом) перед названием родителя.
- Затем определите положение всех заместителей в названии, поместив перед ним число атомов углерода, в котором заместитель присоединяется к исходной цепи. Например, 2-метилгептан указывает на то, что метильный заместитель присоединен к углероду номер 2.
Применение правил
Теперь попробуйте применить эти правила, чтобы назвать следующую молекулу (это не так сложно, как может показаться).
Действуйте шаг за шагом, как описано выше.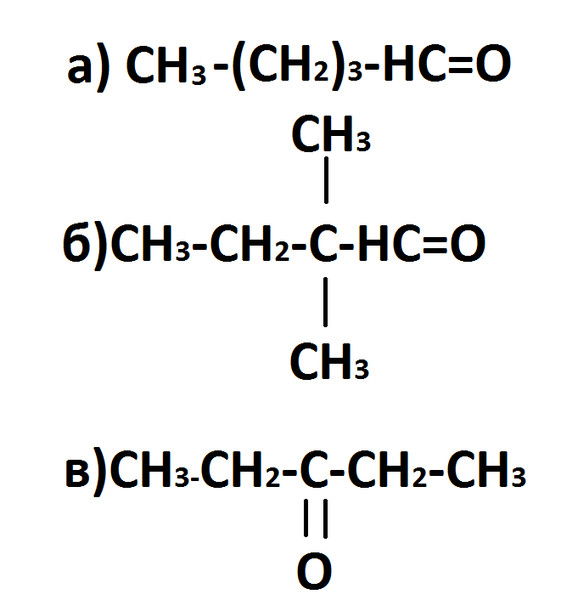
1) Найдите самую длинную углеродную цепь в молекуле. Во-первых, найдите исходную цепь в молекуле, то есть максимально длинную цепочку соединяющих атомов углерода. Обратите внимание, что родительская цепочка не обязательно является цепочкой, которая просто следует слева направо. Например, если бы вы посчитали количество атомов углерода в этой молекуле слева направо, вы бы получили 7 атомов углерода. Однако это не родительская цепочка! Если вы начнете слева, а затем подсчитаете, где молекула разветвляется, вы обнаружите, что в ней 8 атомов углерода. Это самая длинная цепь (не дайте себя обмануть профессорам, прячущим атомы углерода в ответвлениях), и, таким образом, исходной цепью является октан (см. таблицу выше).
2) Номер родительской цепи. Второй шаг — пронумеровать атомы углерода в исходной цепи, начиная с конца, ближайшего к первому заместителю. Важно нумеровать молекулу с правильного конца (другими словами, в этом примере вы нумеруете алкан справа налево или слева направо).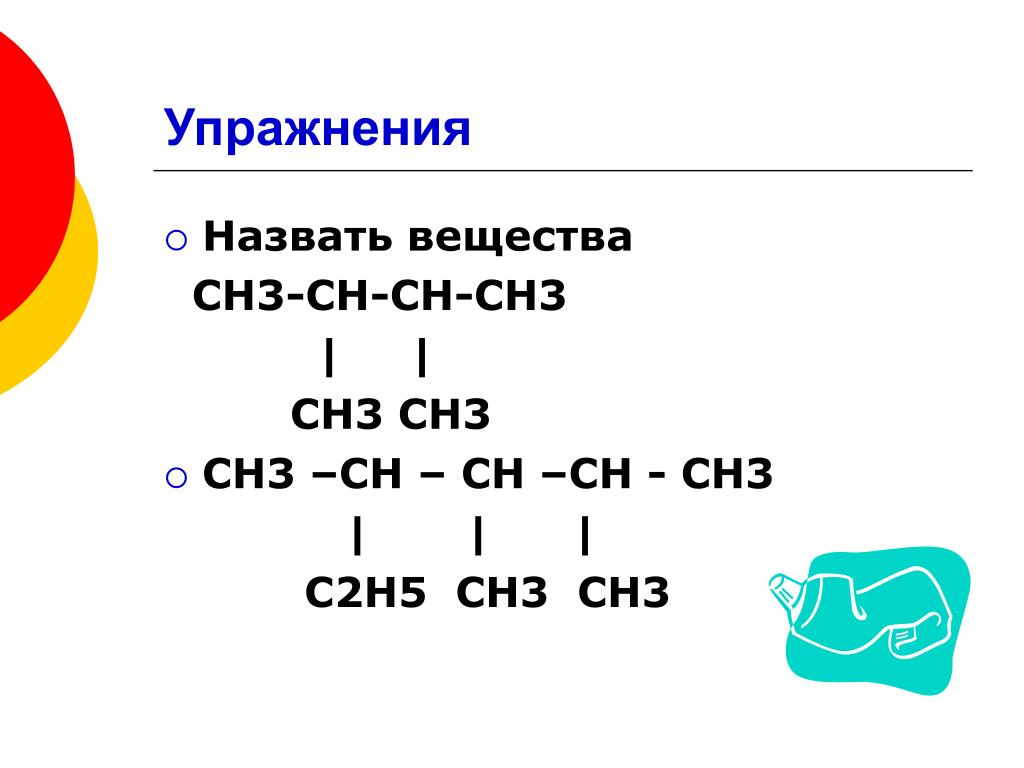 Следуя этому правилу, на этой молекуле вы нумеруете справа налево, так как 2-углеродный заместитель находится ближе к этому концу.
Следуя этому правилу, на этой молекуле вы нумеруете справа налево, так как 2-углеродный заместитель находится ближе к этому концу.
| | |
| Правильная нумерация | Неправильная нумерация |
3. Назовите все заместители. Затем вы определяете названия заместителей. В этом случае единственным заместителем является 2-углеродная группа у 4-го атома углерода. Это этильная группа.
4. Расположите заместители в алфавитном порядке. Следующим шагом является расположение заместителей в алфавитном порядке (т.е. этил перед метилом), но так как есть только один заместитель, в этом нет необходимости.
5. Найдите заместитель в родительском изменении, присвоив ему номер . Таким образом, правильная номенклатура этого алкана — 4-этилоктан. Обратите внимание, что тире используется для отделения числа от заместителя.
Таким образом, правильная номенклатура этого алкана — 4-этилоктан. Обратите внимание, что тире используется для отделения числа от заместителя.
Циклоалканы снова содержат только углерод-водородные связи и углерод-углеродные одинарные связи, но на этот раз атомы углерода соединены в кольцо. Наименьшим циклоалканом является циклопропан.
Если вы посчитаете атомы углерода и водорода, вы увидите, что они больше не соответствуют общей формуле C n H 2n+2 . Соединяя атомы углерода в кольцо, вы должны были потерять два атома водорода.
Вряд ли он вам когда-нибудь понадобится, но общая формула циклоалкана C н Н 2 н .
Не думайте, что это все плоские молекулы. Все циклоалканы от циклопентана и выше существуют в виде «сморщенных колец».
Циклогексан
, например, имеет кольцевую структуру, которая выглядит следующим образом:
Эта форма циклогексана известна как «кресло» из-за его формы, отдаленно напоминающей стул.
Правила ИЮПАК для номенклатуры циклоалканов
1. Для монозамещенного циклоалкана кольцо дает название корня, а группа-заместитель называется, как обычно. Номер места необязателен.
2. Если алкильный заместитель большой и/или сложный, кольцо может быть названо замещающей группой алкана.
3. Если в кольце присутствуют два разных заместителя, они перечислены в алфавитном порядке, и первый указанный заместитель соответствует углероду №1. Затем нумерация атомов углерода в кольце продолжается в направлении (по часовой стрелке или против часовой стрелки), которое дает второму заместителю меньший возможный номер положения.
4. Если в кольце присутствует несколько заместителей, они перечислены в алфавитном порядке. Номера положений присваиваются заместителям таким образом, что один из них находится у углерода № 1, а другие положения имеют наименьшие возможные номера, считая либо по часовой стрелке, либо против часовой стрелки.
5. Название собирается, перечисляя группы в алфавитном порядке и присваивая каждой группе (если их две или более) номер местоположения. Приставки ди, три, тетра и т. д., используемые для обозначения нескольких однородных групп, при алфавитном алфавите не учитываются.
Алкены
Другая серия соединений называется алкенов . Они имеют общую формулу: C n H 2n . Алкены содержат меньше атомов водорода, чем алканы. Оставшиеся дополнительные валентности возникают в виде двойных связей между парой атомов углерода. Двойные связи более реакционноспособны, чем одинарные связи, что делает алкены химически более реакционноспособными.
Правила ИЮПАК для номенклатуры алкенов и циклоалкенов
1. Суффикс ен (окончание) указывает на алкен или циклоалкен.
2. Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода двойной связи 90 552 .
Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода двойной связи 90 552 .
3. Корневая цепь должна быть пронумерована с конца, ближайшего к атому углерода двойной связи . Если двойная связь находится в центре цепи, для определения конца, с которого начинается нумерация, используется правило ближайшего заместителя.
4. Меньшее из двух чисел, обозначающих атомы углерода двойной связи, используется в качестве локатора двойной связи. Если присутствует более одной двойной связи, соединение называется диеновым, триеновым или эквивалентным префиксом, указывающим количество двойных связей, и каждой двойной связи присваивается локаторный номер.
5. В циклоалкенах атомам углерода двойной связи отведены кольцевые позиции №1 и №2. Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
6. Группы заместителей, содержащие двойные связи:
H 2 C=CH– Винильная группа
H 2 C=CH–CH 2 – Аллильная группа
Алкины
Третьей серией являются алкины . Они имеют следующую формулу: C n H 2n-2 .
Они имеют следующую формулу: C n H 2n-2 .
Алкины имеют два атома углерода, соединенных тройной связью. Это очень реакционноспособно, что делает эти соединения нестабильными.
Правила ИЮПАК для номенклатуры алкинов
1. Суффикс yne (окончание) указывает на алкин или циклоалкин.
2. Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода тройной связи 90 552 .
3. Корневая цепь должна быть пронумерована с конца, ближайшего к атому углерода тройной связи . Если тройная связь находится в центре цепи, для определения конца, с которого начинается нумерация, используется правило ближайшего заместителя.
4. Меньшее из двух чисел, обозначающих атомы углерода тройной связи, используется в качестве локатора тройной связи.
5. Если присутствует несколько множественных связей, каждой из них должен быть присвоен номер локатора.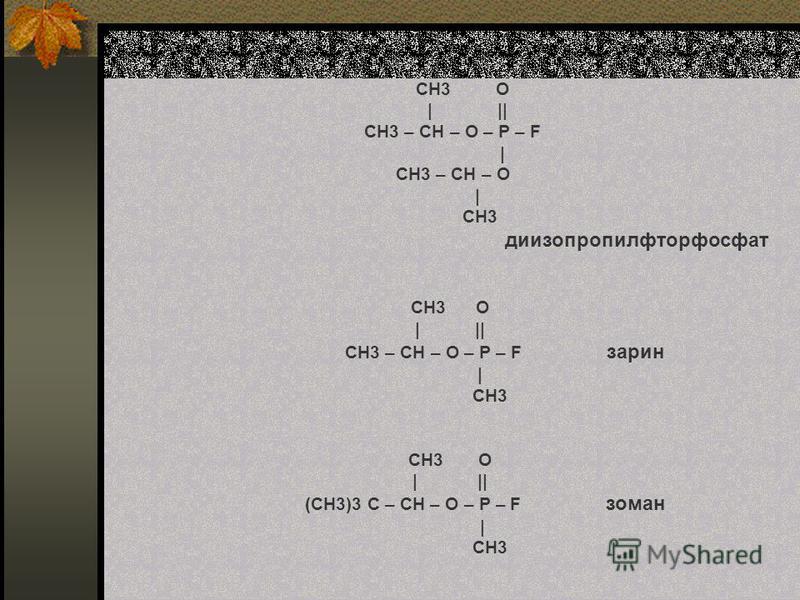 Двойные связи предшествуют тройным связям в названии IUPAC, но цепочка нумеруется с конца, ближайшего к кратной связи, независимо от ее природы.
Двойные связи предшествуют тройным связям в названии IUPAC, но цепочка нумеруется с конца, ближайшего к кратной связи, независимо от ее природы.
6. Поскольку тройная связь является линейной, она может быть размещена только в кольцах размером более десяти атомов углерода. В простых циклоалкинах атомам углерода тройной связи назначаются кольцевые положения № 1 и № 2. Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
7. Группы заместителей, содержащие тройные связи:
HC≡C– Этинильная группа
HC≡CH–CH 2 – Пропаргильная группа
Проблемы:
Нарисуйте структурную формулу 2-бром-4,4-дихлор-5,5-диметилгептана
Нарисуйте структурную формулу 4-бром-1-этилциклопентена
Нарисуйте структурную формулу 7-метил-6-октен-1,3-диина
Названия органических соединений и групп
Названия органических соединений и групп
Основные функциональные группы органических
Химия
Соединение | Примеры | Допустимое имя | Характерные реакции |
Алканы | СН 3 СН 3 | Этан | Свободнорадикальное замещение |
Алкены | CH 2 = CH 2 | Этен или этилен | Электрофильная добавка |
Алкины | Этин или ацетилен | Электрофильная добавка | |
Диенес | СН 2 =СНСН=СН 2 | 1,3-бутадиен | Электрофильная добавка |
Арен | Бензол (C 6 H 6 ) | Электрофильная замена |
.
.
| Соединение | Примеры | Допустимое имя | Характерные реакции |
| Алкилгалогениды | CH 3 CH 2 Класс | Хлорэтан или этилхлорид | Нуклеофильная замена; устранение |
| Алкенилгалогениды | CH 2 = CHCl | Хлорэтилен или винилхлорид | Электрофильная добавка; устранение |
| Арилгалогениды | С 6 Н 5 Класс | Хлорбензол | Электрофильное и нуклеофильное ароматическое замещение |
| Спирты | CH 3 CH 2 ОН | Этанол или этиловый спирт | Обезвоживание; этерификация |
| Фенолы | С 6 Н 5 ОХ | Фенол | Электрофильная замена |
| Эпоксиды | Этиленоксид или оксиран | Раскрытие нуклеофильного кольца | |
| Альдегиды | CH 3 CH | Этаналь или ацетальдегид | Нуклеофильное присоединение к карбонилу |
| Кетон | СН 3 СОСН 3 | 2-пропанон или ацетон | Нуклеофильное присоединение к карбонилу |
| Карбоновые кислоты | СН 3 СООН | Этановая (уксусная) кислота | Кислотная ионизация; образование сложных эфиров |
| Ацилгалогениды | CH 3 COCl | Этаноил(ацетил)хлорид | Нуклеофильная ацильная замена |
| Ангидриды кислот | Этановый (уксусный) ангидрид | Нуклеофильная ацильная замена | |
| Сложные эфиры | Этилэтаноат (ацетат) | Нуклеофильная ацильная замена | |
| Амиды | CH 3 CONHCH 3 | N-метилэтанамид или N-метилацетамид | Нуклеофильная ацильная замена |
| Амины | CH 3 CH 2 NH 2 | Этанамин или этиламин | Азот (основание) как нуклеофил |
| Нитрилы | Китай 3 Китай | Этаннитрил или ацетонитрил | Нуклеофильное присоединение |
Нитро комп. | C 6 H 5 НЕТ 2 | Нитробензол | Восстановление нитро до амина |
| Тиолы | CH 3 CH 2 SH | Этантиол | Окисление до кислот или дисульфидов |
| Сульфиды | CH 3 CH 2 SCH 2 CH 3 | Диэтилсульфид | Алкилирование или окисление |
.
| Соединение | Примеры | Допустимое имя | Характерные реакции |
| Алканы | CH 3 CH 3 | Этан | Свободнорадикальное замещение |
| Алкены | CH 2 =CH 2 | Этен или этилен | Электрофильная добавка |
| Алкины | Этин или ацетилен | Электрофильная добавка | |
| Диенес | СН 2 =СНСН=СН 2 | 1,3-бутадиен | Электрофильная добавка |
| Аренес | Бензол (C 6 H 6 ) | Электрофильная замена | |
| Алкилгалогениды | CH 3 CH 2 Класс | Хлорэтан или этилхлорид | Нуклеофильная замена; устранение |
| Алкенилгалогениды | CH 2 = CHCl | Хлорэтилен или винилхлорид | Электрофильная добавка; устранение |
| Арилгалогениды | С 6 Н 5 Класс | Хлорбензол | Электрофильное и нуклеофильное ароматическое замещение |
| Спирты | Ч 3 CH 2 ОН | Этанол или этиловый спирт | Обезвоживание; этерификация |
| Фенолы | С 6 Н 5 ОХ | Фенол | Электрофильная замена |
| Эпоксиды | Этиленоксид или оксиран | Раскрытие нуклеофильного кольца | |
| Альдегиды | CH 3 CH | Этаналь или ацетальдегид | Нуклеофильное присоединение к карбонилу |
| Кетон | СН 3 СОСН 3 | 2-пропанон или ацетон | Нуклеофильное присоединение к карбонилу |
| Карбоновые кислоты | СН 3 СООН | Этановая (уксусная) кислота | Кислотная ионизация; образование сложных эфиров |
| Ацилгалогениды | CH 3 COCl | Этаноил(ацетил)хлорид | Нуклеофильная ацильная замена |
| Ангидриды кислот | Этановый (уксусный) ангидрид | Нуклеофильная ацильная замена | |
| Сложные эфиры | Этилэтаноат (ацетат) | Нуклеофильная ацильная замена | |
| Амиды | СН 3 КОНХЧ 3 | N-метилэтанамид или N-метилацетамид | Нуклеофильная ацильная замена |
| Амины | CH 3 CH 2 NH 2 | Этанамин или этиламин | Азот (основание) как нуклеофил |
| Нитрилы | Китай 3 Китай | Этаннитрил или ацетонитрил | Нуклеофильное присоединение |
Нитро комп.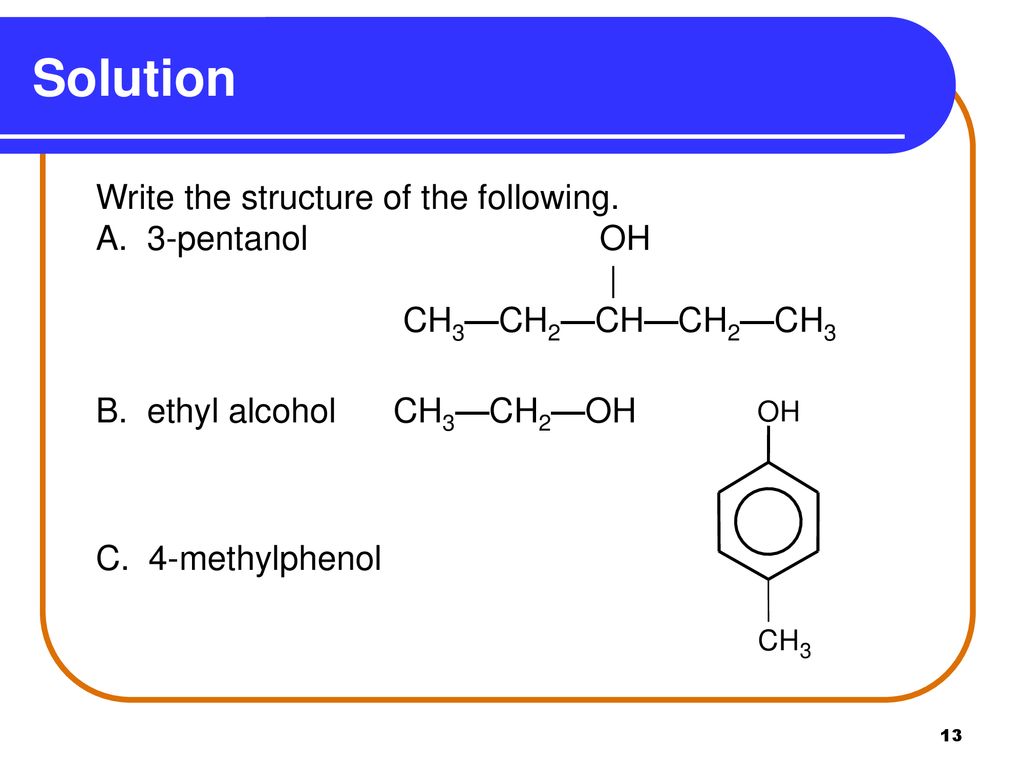 <- Предыдущий пост: Bizon 3d принтер: 3D принтеры BiZon, купить 3Д принтеры БиЗон с доставкой. Цена Следующий пост: Matrix 600: Matrix 600 Pro — Aerial Shop -> <- Предыдущий пост: Bizon 3d принтер: 3D принтеры BiZon, купить 3Д принтеры БиЗон с доставкой. Цена Следующий пост: Matrix 600: Matrix 600 Pro — Aerial Shop -> |

Всего комментариев: 0