Протон h: Mathway | Популярные задачи
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
| Адроны | |
| Альфа-распад | |
| Альфа-частица | |
| Аннигиляция | |
| Антивещество | |
| Антинейтрон | |
| Антипротон | |
| Античастицы | |
| Атом | |
| Атомная единица массы | |
| Атомная электростанция | |
| Барионное число | |
| Барионы | |
| Бета-распад | |
| Бетатрон | |
| Бета-частицы | |
| Бозе – Эйнштейна статистика | |
| Бозоны | |
| Большой адронный коллайдер | |
| Большой Взрыв | |
Боттом. Боттомоний Боттомоний | |
| Брейта-Вигнера формула | |
| Быстрота | |
| Векторная доминантность | |
| Великое объединение | |
| Взаимодействие частиц | |
| Вильсона камера | |
| Виртуальные частицы | |
| Водорода атом | |
| Возбуждённые состояния ядер | |
| Волновая функция | |
| Волновое уравнение | |
| Волны де Бройля | |
| Встречные пучки | |
| Гамильтониан | |
| Гамма-излучение | |
| Гамма-квант | |
| Гамма-спектрометр | |
| Гамма-спектроскопия | |
| Гаусса распределение | |
| Гейгера счётчик | |
| Гигантский дипольный резонанс | |
| Гиперядра | |
| Глюоны | |
| Годоскоп | |
| Гравитационное взаимодействие | |
| Дейтрон | |
| Деление атомных ядер | |
| Детекторы частиц | |
| Дирака уравнение | |
| Дифракция частиц | |
| Доза излучения | |
| Дозиметр | |
| Доплера эффект | |
| Единая теория поля | |
| Зарядовое сопряжение | |
| Зеркальные ядра | |
| Избыток массы (дефект массы) | |
| Изобары | |
| Изомерия ядерная | |
| Изоспин | |
| Изоспиновый мультиплет | |
| Изотопов разделение | |
| Изотопы | |
| Ионизирующее излучение | |
| Искровая камера | |
| Квантовая механика | |
| Квантовая теория поля | |
| Квантовые операторы | |
| Квантовые числа | |
| Квантовый переход | |
| Квант света | |
| Кварк-глюонная плазма | |
| Кварки | |
| Коллайдер | |
| Комбинированная инверсия | |
| Комптона эффект | |
| Комптоновская длина волны | |
| Конверсия внутренняя | |
| Константы связи | |
| Конфайнмент | |
| Корпускулярно волновой дуализм | |
| Космические лучи | |
| Критическая масса | |
| Лептоны | |
| Линейные ускорители | |
| Лоренца преобразования | |
| Лоренца сила | |
| Магические ядра | |
| Магнитный дипольный момент ядра | |
| Магнитный спектрометр | |
| Максвелла уравнения | |
| Масса частицы | |
| Масс-спектрометр | |
| Массовое число | |
| Масштабная инвариантность | |
| Мезоны | |
| Мессбауэра эффект | |
| Меченые атомы | |
| Микротрон | |
| Нейтрино | |
| Нейтрон | |
| Нейтронная звезда | |
| Нейтронная физика | |
| Неопределённостей соотношения | |
| Нормы радиационной безопасности | |
| Нуклеосинтез | |
| Нуклид | |
| Нуклон | |
| Обращение времени | |
| Орбитальный момент | |
| Осциллятор | |
| Отбора правила | |
| Пар образование | |
| Период полураспада | |
| Планка постоянная | |
| Планка формула | |
| Позитрон | |
| Поляризация | |
| Поляризация вакуума | |
| Потенциальная яма | |
| Потенциальный барьер | |
| Принцип Паули | |
| Принцип суперпозиции | |
| Промежуточные W-, Z-бозоны | |
| Пропагатор | |
| Пропорциональный счётчик | |
| Пространственная инверсия | |
| Пространственная четность | |
| Протон | |
| Пуассона распределение | |
| Пузырьковая камера | |
| Радиационный фон | |
| Радиоактивность | |
| Радиоактивные семейства | |
| Радиометрия | |
| Расходимости | |
| Резерфорда опыт | |
| Резонансы (резонансные частицы) | |
| Реликтовое микроволновое излучение | |
| Светимость ускорителя | |
| Сечение эффективное | |
| Сильное взаимодействие | |
| Синтеза реакции | |
| Синхротрон | |
| Синхрофазотрон | |
| Синхроциклотрон | |
| Система единиц измерений | |
| Слабое взаимодействие | |
| Солнечные нейтрино | |
| Сохранения законы | |
| Спаривания эффект | |
| Спин | |
| Спин-орбитальное взаимодействие | |
| Спиральность | |
| Стандартная модель | |
| Статистика | |
| Странные частицы | |
| Струи адронные | |
| Субатомные частицы | |
| Суперсимметрия | |
| Сферическая система координат | |
| Тёмная материя | |
| Термоядерные реакции | |
| Термоядерный реактор | |
| Тормозное излучение | |
| Трансурановые элементы | |
| Трек | |
| Туннельный эффект | |
| Ускорители заряженных частиц | |
| Фазотрон | |
| Фейнмана диаграммы | |
| Фермионы | |
| Формфактор | |
| Фотон | |
| Фотоэффект | |
| Фундаментальная длина | |
| Хиггса бозон | |
| Цвет | |
| Цепные ядерные реакции | |
| Цикл CNO | |
| Циклические ускорители | |
| Циклотрон | |
Чарм.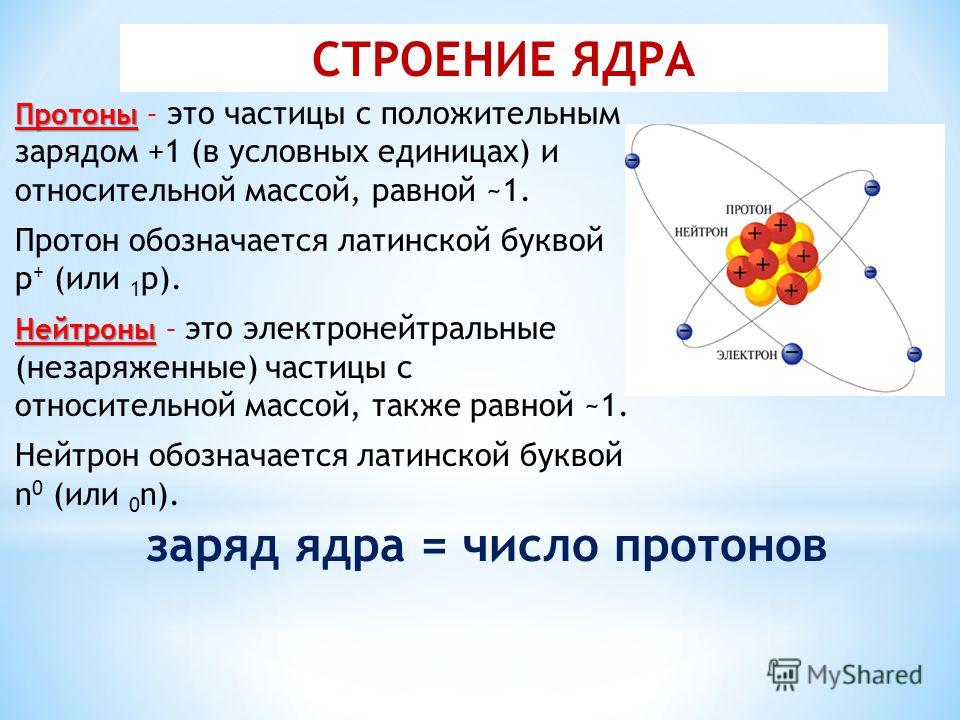 Чармоний Чармоний | |
| Черенковский счётчик | |
| Черенковсое излучение | |
| Черные дыры | |
| Шредингера уравнение | |
| Электрический квадрупольный момент ядра | |
| Электромагнитное взаимодействие | |
| Электрон | |
| Электрослабое взаимодействие | |
| Элементарные частицы | |
| Ядерная физика | |
| Ядерная энергия | |
| Ядерные модели | |
| Ядерные реакции | |
| Ядерный взрыв | |
| Ядерный реактор | |
| Ядра энергия связи | |
| Ядро атомное | |
| Ядерный магнитный резонанс (ЯМР) |
msimagelist>
Протон
Proton
Протон – ядро
атома водорода, элементарная частица, относящаяся к классу барионов. Вместе
Вместе
с нейтроном протон входит в состав всех атомных ядер, определяя величину
его электрического заряда. Масса протона mр =
938.272 088 16(29) МэВ ≈ 1.672 621 923 69(51)·10−24 г. Его спин 1/2ћ и поэтому
он является фермионом.. Протон имеет положительный электрический заряд (равный
по величине заряду электрона е) и магнитный момент μр =+2.79μN, где μN = ећ/2mрс
– ядерный магнетон (использована Гауссова система единиц). Если бы протон
был бесструктурной точечной частицей, то его магнитный момент был бы близок
к μN. Размер протона около 10-13 см.
Он состоит из трёх кварков: двух u-кварков и одного d-кварка, т.е. его кварковая
структура uud.
Протон, являясь барионом, имеет барионное число В = +1. Закон
сохранения барионного числа требует стабильности протона – самого лёгкого
из барионов. Действительно, распад протона никогда не наблюдался и его время
жизни τр > 2.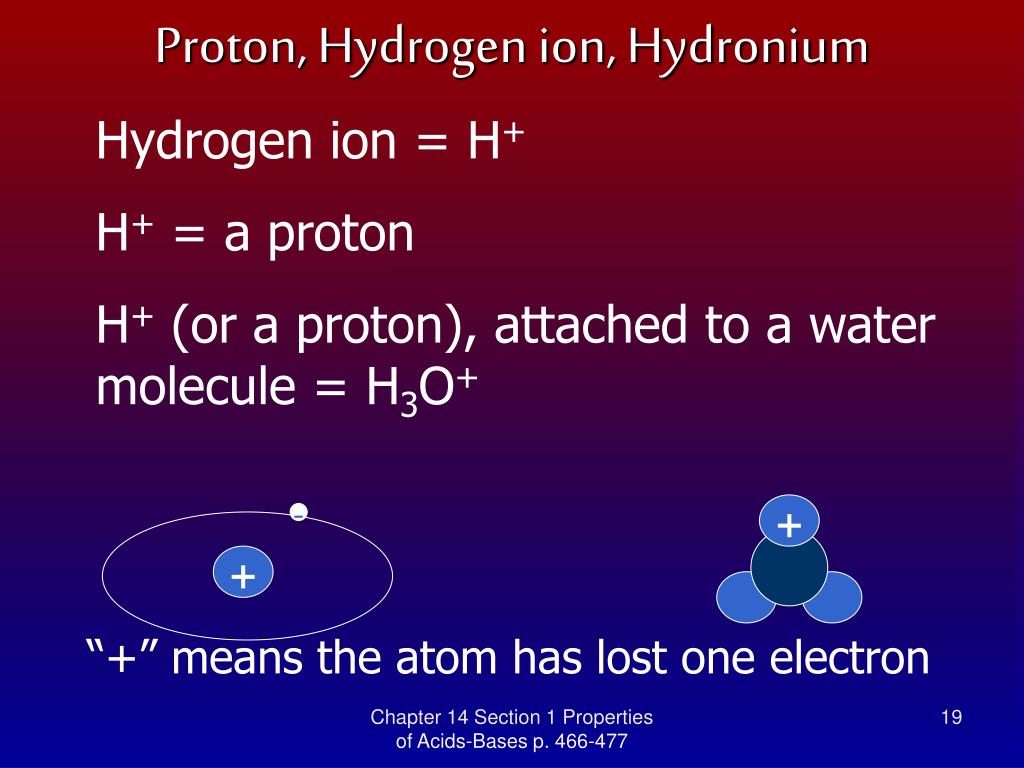 1·1029 лет и, по-видимому,
1·1029 лет и, по-видимому,
даже превышает 1032 лет. Теории Великого объединения взаимодействий
предсказывают распад протона, однако, скорость такого распада исключительно
низка (соответственно время жизни чрезвычайно велико) и экспериментального
подтверждения этого пока не найдено.
Протон, будучи адроном, участвует в сильном взаимодействии, как
и во всех остальных.
См. также
- Proton mass energy equivalent in MeV
- Элементарные составляющие материи
- Структура нуклона
- Структура нуклона
- Изоспин ядра и нуклонов
- Глубоконеупругое рассеяние
электрона на протоне - Взаимные превращения частиц
- Горение водорода
- Протонная радиоактивность и
границы нуклонной устойчивости
Спектроскопия ЯКР 14N выявляет положение протона в связях N–H⋯N: пример с протонными губками
Алан
Грегорович,
* и
Томаж
Апих, и
Веселко
Жагар и
а также
Янез
Селигер аб
Принадлежности автора
*
Соответствующие авторы
и
Институт «Йожеф Стефан», Ямова 39, 1000 Любляна, Словения
Электронная почта:
alan. [email protected]
[email protected]
б
Факультет математики и физики Люблянского университета, Ядранска 19, 1000 Любляна, Словения
Аннотация
Положение протонов в водородных связях часто в некоторой степени неопределенно, поскольку метод, наиболее часто используемый для определения структуры, рентгеновская дифракция, чувствителен к электронной плотности, которой не особенно много вокруг протонов. В водородных связях протоны создают дополнительную проблему: потенциал движения протонов по своей природе ангармоничен и, следовательно, требует учета ядерных квантовых эффектов (ЯКЭ). Здесь мы показываем, что 14 N Спектроскопия ЯКР позволяет достаточно точно определять положения протонов в связях N–H⋯N, в некоторых случаях с точностью, сравнимой с точностью рентгеновской и нейтронной дифракции при комнатной температуре. Сначала мы получаем, используя расчеты ab initio с учетом также NQE, соотношение между расстоянием протона от средней точки связи и разностью между константами квадрупольного взаимодействия для двух позиций азота. Найденная зависимость является линейной с константой пропорциональности 0,108 Å МГц −1 для азота третичных аминов. Затем мы экспериментально подтверждаем наши теоретические расчеты, используя несколько комплексов 1,8-бис(диметиламино)нафталина (ДМАН).
Сначала мы получаем, используя расчеты ab initio с учетом также NQE, соотношение между расстоянием протона от средней точки связи и разностью между константами квадрупольного взаимодействия для двух позиций азота. Найденная зависимость является линейной с константой пропорциональности 0,108 Å МГц −1 для азота третичных аминов. Затем мы экспериментально подтверждаем наши теоретические расчеты, используя несколько комплексов 1,8-бис(диметиламино)нафталина (ДМАН).
В чем разница между H, h3, H+, H- и OH- ?
ВОДА
НОВОСТИ
водный вопрос переехал!
22 мая 2020 г.
Watermatters теперь находится по адресу 3622 W. 4th Ave в Ванкувере, Британская Колумбия.
Различие между этими различными формами водорода может сбивать с толку тех из нас, кто завалил химию в средней школе.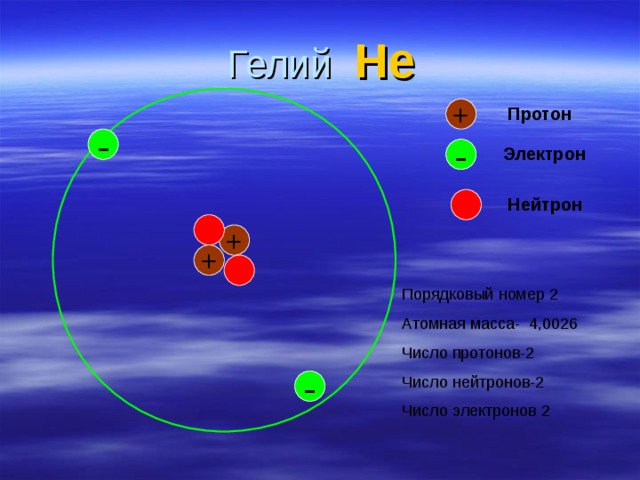 Вот попытка разъяснения.
Вот попытка разъяснения.
H = Атомарный водород
Атомарный водород занимает первое место в Периодической таблице элементов. Он состоит из одного протона и одного неспаренного электрона, что означает, что это свободный радикал.
Однако атом водорода редко существует сам по себе, потому что его неспаренный электрон жадно стремится соединиться с другим электроном.
Более распространена молекулярная форма водорода.
H 2 = Молекулярный водород
H 2 представляет собой газ, который образуется, когда два атома водорода соединяются вместе и становятся молекулой водорода. h3 также называют молекулярным водородом. Он состоит из двух протонов и двух электронов. Следовательно, это наиболее распространенная форма водорода, потому что он стабилен с нейтральным зарядом. h3 не является свободным радикалом. Это антиоксидант в «богатой водородом» воде.
h3 — самая маленькая молекула во Вселенной.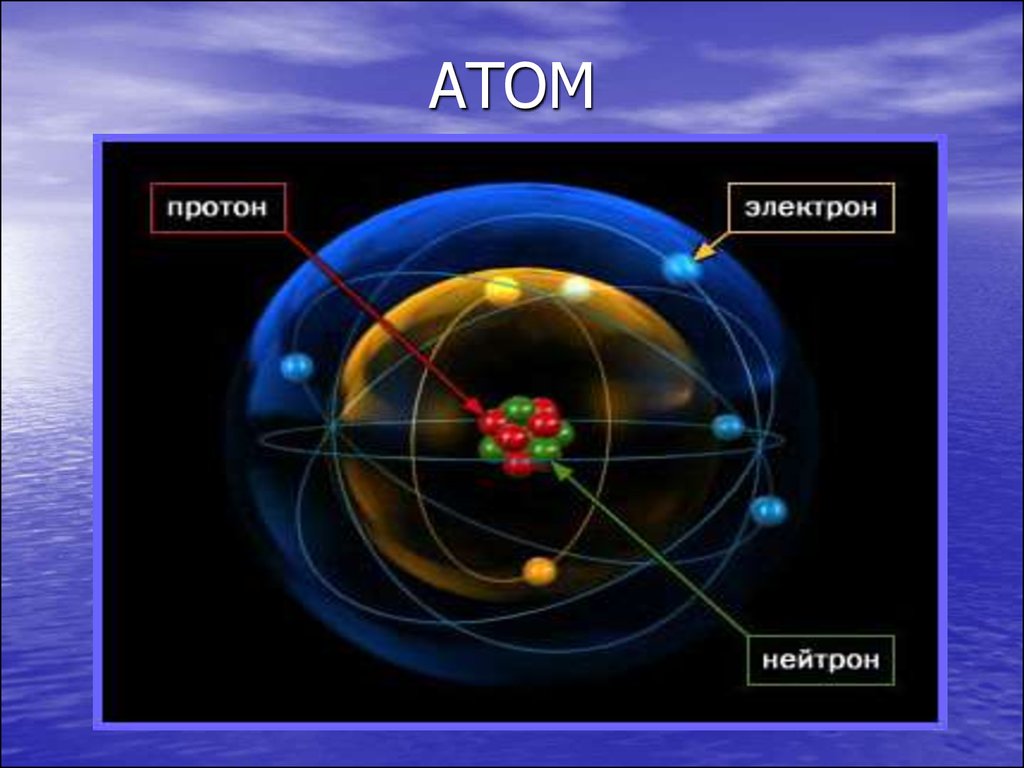 Это означает, что он может проникнуть туда, куда не сможет никто другой… в том числе в ваши митохондрии, которые являются электростанциями ваших клеток. Газообразный водород нельзя держать в пластике, потому что он будет проходить прямо через стенки контейнера.
Это означает, что он может проникнуть туда, куда не сможет никто другой… в том числе в ваши митохондрии, которые являются электростанциями ваших клеток. Газообразный водород нельзя держать в пластике, потому что он будет проходить прямо через стенки контейнера.
H + = Протон
Когда атом водорода теряет электрон, остается только протон. Он становится положительно заряженным ионом водорода, известным как H + . Это форма водорода, которая производит фермент АТФ, питающий наши клетки и митохондрии.
Ион водорода H + является основой шкалы рН.
H: – = гидрид
Гидрид – это атом водорода с дополнительным электроном. Это означает, что это отрицательно заряженный ион или анион . Вот почему гидрид-ион (H-) имеет знак минус, отличающий его от обычного атома водорода (H). Две точки после буквы Н означают, что у этого иона два электрона, а не один.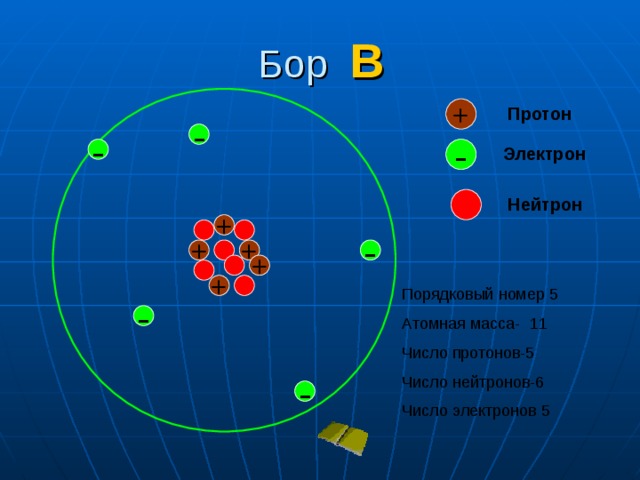 Дополнительный электрон означает, что H- не является свободным радикалом, однако он нестабилен, потому что эта форма водорода является очень сильным основанием (чрезвычайно щелочным), которое реагирует с водой с образованием гидроксида (OH – и молекулярный водород (H 2 ).
Дополнительный электрон означает, что H- не является свободным радикалом, однако он нестабилен, потому что эта форма водорода является очень сильным основанием (чрезвычайно щелочным), которое реагирует с водой с образованием гидроксида (OH – и молекулярный водород (H 2 ).
H: — + H 2 O -> H 2 O + OH —
Гидрид (H: — ) также реагирует с Metals для форм -химического состава, которые являются агентскими.
OH – = ион гидроксида
Гидроксид (OH–) также известен как ион гидроксила. Когда вода диссоциирует или распадается на составные части, она образует ОН – (ионы гидроксида) и H 3 O + (ионы гидроксония).
2H 2 O ⇆ OH — и H 3 O +
. Эта реакция переносится. Ион гидроксида также реагирует с ионом гидроксония (h4O+), превращаясь в две молекулы воды.
Эта реакция переносится. Ион гидроксида также реагирует с ионом гидроксония (h4O+), превращаясь в две молекулы воды.
Ион гидроксида (OH – ) является основанием (щелочным). Ион гидроксида не является свободным радикалом или антиоксидантом. Растворенный молекулярный газообразный водород (h3) является антиоксидантом в «богатой водородом» воде.
Гидроксид (OH – ) иногда путают с гидроксильным радикалом (OH • ). Точка справа вверху от ОН указывает на неспаренный электрон, что означает, что гидроксил является свободным радикалом, на самом деле одним из наиболее реакционноспособных кислородных радикалов. Гидроксид и гидроксил — это два совершенно разных вида. Важно их не путать.
H 3 O + = ион гидроксония
Молекула воды (H 2 0) плюс ион водорода (H + ) становится ионом гидроксония (H 3 O + ). Ион H + представляет собой одинокий протон с мощным зарядом.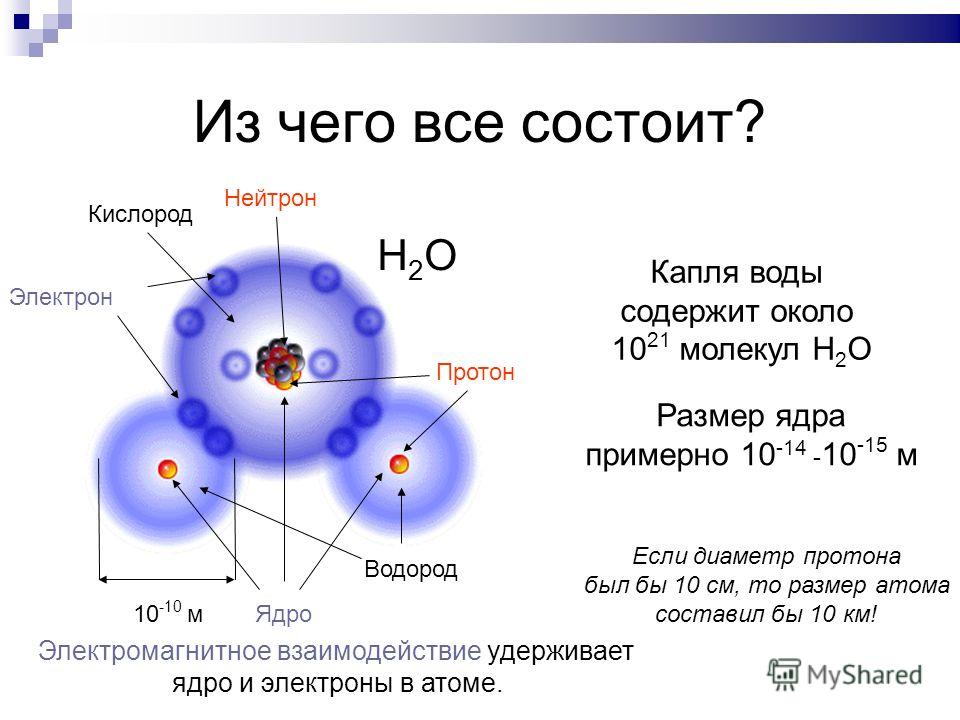 Он не существует сам по себе в водном растворе, потому что сразу же притягивается к неподеленным электронам в атоме кислорода H 2 O. В результате получается гидроксоний (H 3 O + ). Этот процесс обратим. Две молекулы воды могут диссоциировать с образованием гидроксония и гидроксида.
Он не существует сам по себе в водном растворе, потому что сразу же притягивается к неподеленным электронам в атоме кислорода H 2 O. В результате получается гидроксоний (H 3 O + ). Этот процесс обратим. Две молекулы воды могут диссоциировать с образованием гидроксония и гидроксида.
2H 2 О ⇆ OH – и H 3 O +
Эксперименты показывают, что протон (H + ) очень неразборчив. Он меняется от одного партнера H 2 O к другому много раз в секунду, создавая новый ион H 3 O + по мере своего движения.
pH = потенциал водорода
pH обозначает потенциал водорода и на самом деле является измерением концентрации ионов водорода (H+) в растворе. Вода распадается (диссоциирует) на протоны (H + ) и гидроксиды (ОН – ). Эта реакция обратима.
Эта реакция обратима.
H 2 O ⇆ H + and OH –
2H 2 O ⇆ OH – and H 3 O +
pH показывает, является ли вода кислой, нейтральной или щелочной. Подробнее H + = более кислый. Меньше H + = более щелочной.
Поскольку H+ сразу связывается с H 2 O с образованием H 3 O + (гидроний), можно также сказать, что pH является мерой концентрации H 3 O + в растворе. .
Шкала рН логарифмическая. Увеличение на 1 по шкале pH приводит к 10-кратному уменьшению концентрации ионов гидроксония, а увеличение на 3 по шкале pH приводит к уменьшению концентрации ионов гидроксония в 1000 раз.

Всего комментариев: 0