Применение высоких и низких температур в медицине таблица: «Применение низких температур в медицине.. Тимониной Александры 11 группа.». Скачать бесплатно и без регистрации.
Содержание
Влияние высоких и низких температур производственной среды на организм человека
Основные виды производств с нагревающим и охлаждающим микроклиматом
Работа на открытом воздухе в различное время года:
- Сельское хозяйство
- Строительство
- Горное дело и работа в шахтах
- Нефтяные разработки
- Лесозаготовка
- Рыбное хозяйство
Работа в неотапливаемых складских помещениях и подвалах.
Работа у холодильных установок.
Производственные процессы, связанные с интенсивным тепловым излучением — горячие цеха литейного производства
Патогенез воздействия на организм высоких и низких температур
Основные виды терморегуляции в организме координируют подкорковые центры и кора мозг:
- Теплообразование, которое связано с интенсивностью обменных процессов
- Теплоотдача (излучение, проведение тепла, испарение)
Оптимальными метеорологическими условиями для человека являются температура воздуха 18-21 градус по Цельсию при относительной влажности 40-60% и скорости движения воздуха 0,5-1 м/сек.
Воздействие высоких температур
При перегревании наблюдается активация процессов теплоотдачи, что сопровождается:
- Расширением сосудов кожи
- Ускорением кровотока
- Усилением потоотделения и потерей с потом больших количеств воды, солей, некоторых органических веществ, что ведет к:
- дегидратации с нарушением водно-солевого обмена
- нарушениям ССС и ЖКТ
Острые тепловые заболевания вызываются микроклиматом с преобладанием конвекционного тепла в рабочей зоне (высокая температура воздуха с незначительной подвижностью и высокой относительной влажностью):
— Тепловой удар
— Тепловое истощение
— Тепловой обморок
— Тепловые судороги
— Тепловой отек
— Обезвоживание
При воздействии нагревающего микроклимата:
- Усиливается кровоток через кожу за счет расширения кожных сосудов, увеличения частоты сердечных сокращений и минутного объема крови
- Нарастает давление в сосудах, повышается проницаемость сосудистой стенки, появляются кровоизлияния и отек
- Интенсивное потоотделение приводит к обезвоживанию и потери солей натрия, кальция, калия, фосфора, микроэлементов (медь, цинк, йод и др.
 ), водорастворимых витаминов и др.
), водорастворимых витаминов и др. - Наблюдается сгущение крови, что приводит к развитию острой сердечно-сосудистой недостаточности
Тепловой удар (острое тепловое поражение)
Легкая степень:
Неспецифические проявления:
- Повышенная усталость
- Вялость, сонливость
- Головная боль
- Тошнота
Симптомы нарушения терморегуляции:
- Повышение температуры тела до субфебрильной
- Умеренное потоотделение
- повышение ЧСС
Средняя степень
Неспецифические проявления:
- Общая разбитость
- нарастание сонливости и головной боли
- Рвота
Симптомы нарушение терморегуляции:
- Гипертермия, Т повышается до 40-41 градусов
- Учащение ЧД и ЧСС
- Повышение АД
Тяжелая степень:
Быстрое нарастание поражения ЦНС:
- Потеря сознания или психомоторное возбуждение
- Тошнота и рвота
- Угасание рефлексов
- Появление судорог, парезы и параличи
- Возможны кома, остановка дыхания
Выраженные симптомы нарушенной терморегуляции:
- Гипертермия , Т до 42 градусов
- ЧД до 30-4- в 1 мин, пульс 120-140 в минуту
- Дегидратация и гипохлоргидрия (изменения на ЭКГ)
- Тепловая потница
После перенесенного острого теплового поражения наблюдается:
- снижение толерантности к теплу,
- ВДС,
- нарушение терморегуляции,
- астенический синдром
Тепловое истощение – возникает при воздействии нагревающего микроклимата в результате потери солей или срыва функции потоотделения.
Различают 2 типа:
Тип 1 – при потере солей при усилении потоотделения в самые жаркие периоды времени года
Тип 2 – перегрев в результате срыва функции потоотделения, характеризуется нарушением гемодинамики
Клиника теплового истощения
Неспецифические проявления: усталость, вялость, сонливость, головная боль, тошнота
Симптомы нарушенной терморегуляции: Т тела – субфебрильная, повышено потоотделение,
учащение ЧД и ЧСС
Тепловой обморок (тепловой коллапс) – острое нарушение сердечно-сосудистой системы вследствие интенсивной мышечной работы при высокой температуре окружающей среды.
Чаще встречается у молодых при сниженной адаптации.
Клиника:
— Потеря сознания
— Бледность кожных покровов
— Падения АД и нитевидный пульс
— Предшествуют: слабость, шум в ушах, головокружение, нарастание ЧСС и ЧД, усиленное потоотделение
Тепловые судороги — мышечные спазмы вследствие прогрессирующего обезвоживания и острого нарушения водно-солевого обмена: развивается внеклеточная дегидратация с внутриклеточной гипергидратацией (водная интоксикация клетки – алкалоз)
Клиника:
Мышечные спазмы тетанического характера в группах мышц (икроножных, бедер, плеч, предплечий), резкая их болезненность во время движения
Больные адинамичны, кожа сухая, холодная, ЧСС до 110-120 в 2 мин, АД низкое, тоны глухие, падение диуреза, признаки сгущения крови: повышение ЭР и гемоглобина
Тепловой отек – нарушение водносолевого обмена и накопление жидкости в организме
Клиника: отеки нижних конечностей, затем отеки верхних конечностей
Диагностика острых заболеваний от воздействия нагревающего микроклимата
Данные анамнеза: работа в условиях интенсивного воздействия нагревающего микроклимата, превышающего допустимые параметры, подтвержденными сведениями о:
— трудовой деятельности и
— санитарно-гигиенической характеристикой условий труда
Осмотр: окраска и влажность кожных покровов, ЧСС и ЧД, АД, наличие потницы
Данные обследования:
— Общ. Ан. Крови – увеличение ЭР и гемоглобина
Ан. Крови – увеличение ЭР и гемоглобина
— Биохимия: белки, калий, натрий, хлориды
— ЭКГ
— Кожная термометрия
Для дифференциальной диагностики: консультации кардиолога, невролога, дерматолога и инфекциониста
Лечение
Перемещение больного в затемненное и прохладное помещение, холодные компрессы или грелки со льдом на голову, влажные обертывания. Диета с повышенным содержанием соли.
При легкой степени –
- теплый душ с Т воды=26-27 градусов на 5-6 минут с последующим сухим обтиранием и покой
При средней степени:
- Теплые ванны с Т воды 29 градусов на 7-8 мин, затем душ и покой
- Обтирание влажными простынями, намоченными водой Т 25-26 градусов (10-15 мин), затем обтирание и покой
При тяжелой степени:
- Орошение больного прохладной водой
- Влажные компрессы на область груди и живота
Медикаментозное лечение (симптоматическое):
- Сердечно-сосудистые средства (камфора, кофеин)
- Физ р-р в/в
- Кровопускание
- Седативные
Примерные сроки нетрудоспособности:
При легкой степени – 3-5 дней
При средней степени без осложнений: 5-10 дней
При средней степени с осложнениями 10-15 дней
При тяжелой степени без осложнений 15-30 дней
При тяжелой степени с осложнениями 30-45 дней
Прогноз:
при легкой и средней степени – полное выздоровление
При тепловом ударе тяжелой степени возможен летальный исход
Летальность 20-25%
Профилактика:
— Специальные технические и санитарно-гигиенические мероприятия (вентилляция, теплоизолирующие материалы и др. , регламентируемые перерывы в работе с перемещением работника в помещения с оптимальными параметрами климата)
, регламентируемые перерывы в работе с перемещением работника в помещения с оптимальными параметрами климата)
— Индивидуальные средства защиты
— Разработка специального питьевого и пищевого режима
— Предварительные и периодические профосмотры.
Противопоказания к работе:
— ГБ тяжелого течения,
— Хронические болезни сердца и перикарда, ИБС,
— Выраженные расстройства автономной нервной системы,
— Хронические заболевания органов дыхания и кожи
— Катаракта
Факторы, предрасполагающие к тепловому удару:
— Острые и хронические заболевания с поражением кожных покровов и дегидратацией
— Употребление алкоголя
— Бессонница
Хроническая тепловая болезнь (хронический перегрев) – хроническое тепловое поражение организма человека при длительном воздействии на рабочем месте нагревающего микроклимата, превышающего допустимые параметры, определяемыми санитарно-гигиеническими нормами.
Клиника: ВСД перманентного и пароксизмального течения с нарушениями терморегуляции, снижением резистентности эритроцитов и нарушениями электролитного обмена.
Жалобы:
Головная боль, раздражительность, вялость, потливость, нарушение сна, головокружение
Боли в области сердца, тахикардия
Судороги мышц, неустойчивость походки
Объективно: положительные вегетативные пробы, неустойчивость ритма и АД, настроения
Диагностика:
— Клиника
— Лабораторные исследования:
— Анализ крови: снижение эритроцитов и гемоглобина\определение терморезистентности эритроцитов (менее 120 с)
— Биохимия: хронический дефицит хлорида натрия, калия, кальция, магния
— Инструментальные исследования:
— ЭКГ (дистрофические изменения)
— ЭЭГ: изменение функции и увеличение числа стволовых дисфункций
— РЭГ
— УЗДГ магистральных сосудов головы и шеи
— Вегетативные пробы
Лечение:
Средства для нормализации вегетативного и сосудистого тонуса
Коррекция макроэлементных нарушений: восполнение ионов натрия, хлора, калия, кальция и магния
Восполнение недостатка витаминов
Сроки нетрудоспособности – до нормализации клиники и всех измененных показателей
Тепловое излучение в производственных условиях может сочетаться с инфракрасным (в горячих цехах) или ультрафиолетовым (при газо- и электросварке) излучением.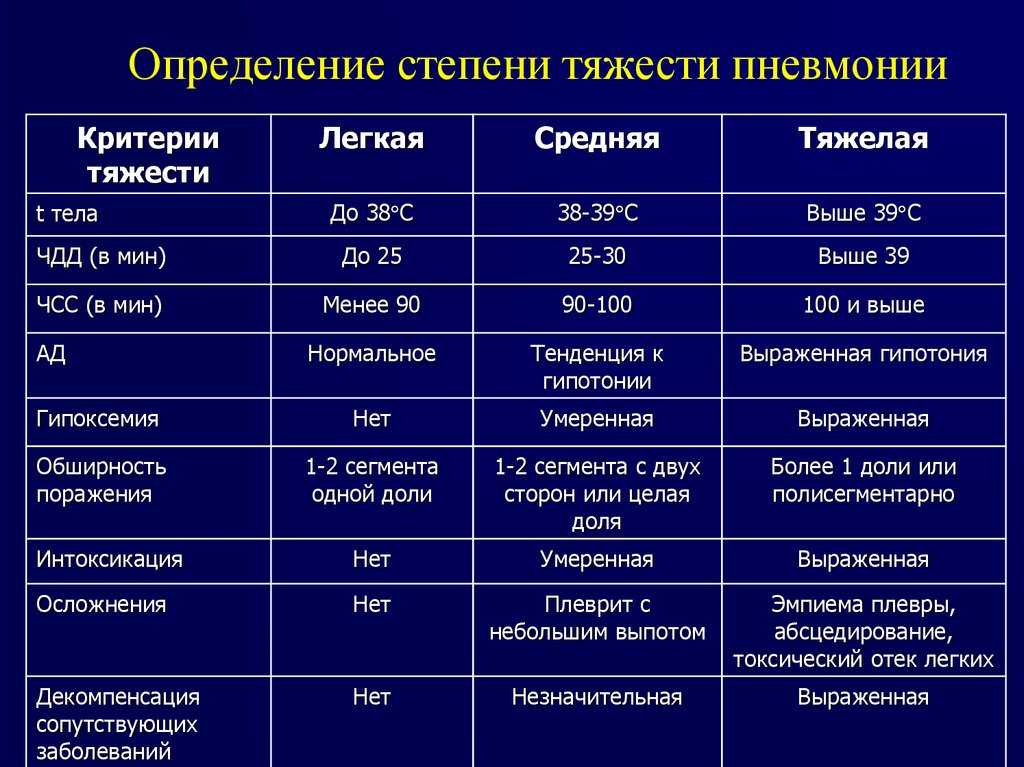
Инфракрасное излучение вызывает развитие катаракты, хронические блефариты и блефароконъюнктивиты.
Ультрафиолетовое излучение вызывает острые кератоконъюнктивиты (электроофтальмии)
Тепловая (огненная) катаракта — обусловленная систематическим воздействием инфракрасного излучения возникает у работников при повышении его интенсивности при стаже работы 15-20 лет
при выполнении кузнечно-прессовых, электросварочных и термических работ, при производстве изделий из стекла в металлургическом производстве.
Клиника: медленное постепенное снижение остроты зрения вплоть до светоощущения. В начале возникают помутнения в заднем кортикальном слое хрусталика, в дальнейшем помутнение продвигается по оси хрусталика кпереди.
Диагностика:
Определение остроты зрения
Офтальмоскопия
Применение высокопоточной оксигенации в терапии острого респираторного дистресс-синдрома
Кислородотерапия является средством первого ряда для лечения гипоксемической дыхательной недостаточности, однако эффективность этой методики ограничена, особенно при необходимости наращивания фракции вдыхаемого кислорода. Следует также учитывать, что при использовании стандартной маски или носовых канюль фракция вдыхаемого кислорода, как правило, не превышает 40% за счет «примешивания» окружающего воздуха. Ограничены также возможности подогрева дыхательной смеси и поддержания положительного давления в конце выдоха, что снижает клиническую эффективность метода [1]. Альтернативой в таких случаях является инвазивная искусственная вентиляция легких (ИВЛ). Данный метод сам по себе является жизнеспасающим, но при этом не лишен ряда недостатков. К наиболее частым осложнениям ИВЛ относят вентилятор-ассоциированную пневмонию и трахеобронхит, баро-, волюмо-, оксигено- и ателектотравму [2—5].
Следует также учитывать, что при использовании стандартной маски или носовых канюль фракция вдыхаемого кислорода, как правило, не превышает 40% за счет «примешивания» окружающего воздуха. Ограничены также возможности подогрева дыхательной смеси и поддержания положительного давления в конце выдоха, что снижает клиническую эффективность метода [1]. Альтернативой в таких случаях является инвазивная искусственная вентиляция легких (ИВЛ). Данный метод сам по себе является жизнеспасающим, но при этом не лишен ряда недостатков. К наиболее частым осложнениям ИВЛ относят вентилятор-ассоциированную пневмонию и трахеобронхит, баро-, волюмо-, оксигено- и ателектотравму [2—5].
В качестве еще одного метода респираторной терапии может выступать неинвазивная вентиляция легких (НИВЛ). Данная методика хорошо зарекомендовала себя в лечении декомпенсации хронической обструктивной болезни легких (ХОБЛ), некардиогенного и кардиогенного отека легких [6—12]. К факторам, ограничивающим ее активное применение, можно отнести трудоемкость метода, а в ряде ситуаций — дискомфорт для пациента. В начале XXI века для респираторной поддержки пациентов в критическом состоянии начали рассматривать еще менее инвазивную методику — высокопоточную оксигенацию (ВПО) [6, 12, 13]. Последняя имеет ряд преимуществ перед стандартной оксигенотерапией и НИВЛ в лечении артериальной гипоксемии, не вызывает существенного дискомфорта у больного и обеспечивает величину инспираторного потока, близкую к потребностям пациента с дыхательной недостаточностью (40—60 л/мин) [14, 15].
В начале XXI века для респираторной поддержки пациентов в критическом состоянии начали рассматривать еще менее инвазивную методику — высокопоточную оксигенацию (ВПО) [6, 12, 13]. Последняя имеет ряд преимуществ перед стандартной оксигенотерапией и НИВЛ в лечении артериальной гипоксемии, не вызывает существенного дискомфорта у больного и обеспечивает величину инспираторного потока, близкую к потребностям пациента с дыхательной недостаточностью (40—60 л/мин) [14, 15].
Возможности применения ВПО в терапии острого респираторного дистресс-синдрома (ОРДС) являются в настоящее время предметом повышенного интереса со стороны врачей-анестезиологов-реаниматологов и требуют активного изучения. На данный момент нет четких алгоритмов по применению ВПО при ОРДС, не определены оптимальные показания для использования данной методики у этой категории больных, что побудило авторов к написанию обзора.
Высокопоточная оксигенация: ключевые принципы
Высокопоточная назальная оксигенация позволяет обеспечить доставку увлажненной и подогретой кислородно-воздушной смеси с фракцией вдыхаемого кислорода от 21 до 100% и величиной потока до 80 л/мин. Методика ВПО включает различные системы для эффективного увлажнения и согревания газовой смеси [13].
Методика ВПО включает различные системы для эффективного увлажнения и согревания газовой смеси [13].
Принципиальными особенностями ВПО являются возможности пошаговой регуляции скорости потока и температуры, а также точность установки фракции вдыхаемого кислорода. Современные системы ВПО располагают специальными дыхательными контурами из полупроницаемого материала, не допускающего образования конденсата, а также оригинальными носовыми или трахеостомическими канюлями. При этом максимальный поток, тип увлажнения и дизайн носовых канюль варьируют в зависимости от модели устройства. На сегодняшний день оборудование для высокопоточной кислородотерапии представлено несколькими производителями [13, 14]. Кроме того, ВПО стала появляться в качестве дополнительной опции на аппаратах ИВЛ [15].
Основные эффекты высокопоточной назальной оксигенации
Основными положительными эффектами ВПО являются соответствие величины потока аппарата на вдохе потоку в дыхательных путях пациента с дыхательной недостаточностью и возможность повышения фракции кислорода на вдохе. К физиологическим эффектам ВПО относится и уменьшение мертвого пространства дыхательных путей, что обеспечивается за счет высокого потока кислородно-воздушной смеси (эффект вымывания, washout effect). Более того, высокий поток обеспечивает динамический рост давления в дыхательных путях на выдохе (эффект положительного давления в конце выдоха, ПДКВ), что способствует расправлению спавшихся альвеол и вовлечению их в газообмен [16, 17]. Повышение ПДКВ на фоне высокопоточной назальной оксигенации ограничено 2—7 см вод. ст., поэтому оно не сопровождается нарушениями гемодинамики [13, 18, 19]. Поток газовой смеси с температурой от 31 °C и выше дает возможность дополнительного согревания и увлажнения слизистой дыхательных путей, что благоприятно влияет на газообмен и переносимость пациентом процедуры. Благодаря оригинальной методике постоянного испарения влаги в контуре обеспечивается оптимальная влажность подаваемой смеси.
К физиологическим эффектам ВПО относится и уменьшение мертвого пространства дыхательных путей, что обеспечивается за счет высокого потока кислородно-воздушной смеси (эффект вымывания, washout effect). Более того, высокий поток обеспечивает динамический рост давления в дыхательных путях на выдохе (эффект положительного давления в конце выдоха, ПДКВ), что способствует расправлению спавшихся альвеол и вовлечению их в газообмен [16, 17]. Повышение ПДКВ на фоне высокопоточной назальной оксигенации ограничено 2—7 см вод. ст., поэтому оно не сопровождается нарушениями гемодинамики [13, 18, 19]. Поток газовой смеси с температурой от 31 °C и выше дает возможность дополнительного согревания и увлажнения слизистой дыхательных путей, что благоприятно влияет на газообмен и переносимость пациентом процедуры. Благодаря оригинальной методике постоянного испарения влаги в контуре обеспечивается оптимальная влажность подаваемой смеси.
Таким образом, подогрев и адекватное увлажнение смеси способствуют улучшению клиренса слизистого секрета, что уменьшает бронхообструкцию и препятствует дальнейшему ателектазированию. Следует также отметить, что создание высокого потока сводит к минимуму «примешивание» окружающего воздуха, позволяя обеспечить стабильную и управляемую фракцию вдыхаемого кислорода, вплоть до 100% [20, 21]. Описанные эффекты позволяют улучшить элиминацию углекислого газа (СО2), снизить частоту дыхания и стабилизировать показатели оксигенации (рис. 1). Рис. 1. Физиологические эффекты высокопоточной оксигенации. Более того, показано, что методика ВПО достаточно проста в использовании и не сопровождается серьезными временными затратами со стороны персонала, а также легче переносится пациентами [14].
Следует также отметить, что создание высокого потока сводит к минимуму «примешивание» окружающего воздуха, позволяя обеспечить стабильную и управляемую фракцию вдыхаемого кислорода, вплоть до 100% [20, 21]. Описанные эффекты позволяют улучшить элиминацию углекислого газа (СО2), снизить частоту дыхания и стабилизировать показатели оксигенации (рис. 1). Рис. 1. Физиологические эффекты высокопоточной оксигенации. Более того, показано, что методика ВПО достаточно проста в использовании и не сопровождается серьезными временными затратами со стороны персонала, а также легче переносится пациентами [14].
Простота использования метода и «дружелюбный» интерфейс минимизируют потенциальную возможность ошибок в результате человеческого фактора. Основные противопоказания к ВПО включают нарушение сознания, высокий риск аспирации и обструкцию носовых ходов (травма, кровотечение, операция) [17, 20, 22]. Проведение ВПО может быть крайне опасным у пациентов с переломом основания черепа в связи с риском пневмоцефалии и менингита [17]. Кроме того, у пациентов с ХОБЛ при использовании ВПО с высокой фракцией кислорода возможно развитие респираторного ацидоза вследствие снижения частоты дыхательных движений и гиповентиляции [17, 22]. К специфическим, но достаточно редким проблемам проведения ВПО относят раздражение, дискомфорт и заложенность слизистой носоглотки, ощущение избыточного тепла, нарушения обоняния, дополнительный шумовой эффект и аэрофагию [17].
Кроме того, у пациентов с ХОБЛ при использовании ВПО с высокой фракцией кислорода возможно развитие респираторного ацидоза вследствие снижения частоты дыхательных движений и гиповентиляции [17, 22]. К специфическим, но достаточно редким проблемам проведения ВПО относят раздражение, дискомфорт и заложенность слизистой носоглотки, ощущение избыточного тепла, нарушения обоняния, дополнительный шумовой эффект и аэрофагию [17].
Определенную озабоченность вызывают вопросы инфекционной безопасности применения ВПО. В ходе ряда исследований оценена степень бактериального загрязнения окружающей среды на фоне использования высокопоточных носовых канюль по сравнению с обычной кислородной маской у пациентов с пневмонией.
Результаты показали, что использование ВПО не ассоциировалось с ростом контаминации окружающей среды грамотрицательными или иными бактериями [13, 23].
Преимущества стандартной кислородотерапии, высокопоточной назальной оксигенации и НИВЛ [22—24] суммированы в таблице. Таблица. Сравнение стандартной кислородотерапии, высокопоточной оксигенации и неинвазивной вентиляции легких
Таблица. Сравнение стандартной кислородотерапии, высокопоточной оксигенации и неинвазивной вентиляции легких
Высокопоточная оксигенация в лечении ОРДС
С момента первого описания ОРДС в 1967 г. прошло более полувека, однако данное состояние до сих пор является одной из ключевых проблем в отделении интенсивной терапии (ОИТ) и сопровождается высокой летальностью [25, 26]. Исход лечения ОРДС зависит от многих факторов, из них решающее значение имеют следующие: в какой стадии ОРДС начато лечение и насколько оно эффективно, какие еще органы и системы поражены, насколько устранима причина, вызвавшая ОРДС [5]. Большую роль играет и проведение респираторной поддержки, необходимой для обеспечения адекватного газообмена в легких, уменьшения работы дыхания, расправления спавшихся альвеол и поддержания нестабильных альвеол в раскрытом состоянии во время выдоха [5, 20, 25, 27].
Использование ВПО на начальных этапах лечения ОРДС
Возможность применения ВПО как стартовой терапии гипоксемической дыхательной недостаточности, в том числе ОРДС, активно обсуждается в медицинской литературе последних лет [28—30].
Однако стоит учитывать, что нарушение сознания, полиорганная недостаточность и шок являются противопоказаниями к использованию данного метода. Кроме того, одна из опасностей использования ВПО на начальных этапах лечения гипоксемической дыхательной недостаточности заключается в возможной задержке необходимой интубации трахеи, что, в свою очередь, может ухудшить результат лечения больного [29]. Наличие четких критериев для начала ИВЛ облегчает принятие такого решения.
Следует также иметь в виду, что, если в течение первого часа от начала ВПО у пациента с гипоксемической дыхательной недостаточностью не отмечено существенного клинического улучшения, риск дальнейшей неэффективности подобного лечения становится очень высоким [30]. В качестве факторов риска неэффективности ВПО при ОРДС отмечены отсутствие улучшения оксигенации, сохраняющееся тахипноэ, а также участие вспомогательной мускулатуры в акте дыхания [30]. В числе нереспираторных предикторов неудачного проведения ВПО, как правило, выделяют потребность в вазопрессорах, тахикардию, тяжесть исходного заболевания, а также полиорганную недостаточность [27—29]. Кроме того, ВПО становится неэффективной при большом объеме плеврального выпота, когда приоритетом в лечении дыхательной недостаточности становится плевральная пункция [31].
Кроме того, ВПО становится неэффективной при большом объеме плеврального выпота, когда приоритетом в лечении дыхательной недостаточности становится плевральная пункция [31].
Имеющиеся на данный момент исследования относительно эффективности ВПО при гипоксемической дыхательной недостаточности противоречивы. Так, J. Frat и соавт. в своем многоцентровом исследовании, в которое включены преимущественно пациенты с пневмонией, показали, что ВПО не снижает риск интубации по сравнению с традиционной оксигенотерапией и НИВЛ (38, 47 и 50% соответственно, р=0,18) [24]. Это может объясняться ограниченными возможностями мобилизации альвеол у этой категории больных и отсутствием у них выраженных нарушений механики дыхания. Тем не менее в подгруппе пациентов с PaO2/FiO2, равном или менее 200 мм рт.ст., частота интубации трахеи и количество дней без ИВЛ к 28-м суткам исследования были статистически значимо ниже на фоне ВПО. Кроме того, ВПО сопровождалась большим комфортом, снижением выраженности дыхательной недостаточности и уменьшением тахипноэ по сравнению с НИВЛ и традиционной оксигенотерапией [24].
Анализируя результаты последних cтатей и обзоров, можно отметить, что применение ВПО у пациентов с дыхательной недостаточностью различного генеза снижает частоту интубации по сравнению со стандартной кислородотерапией и НИВЛ, не влияя при этом на длительность пребывания в ОИТ и летальность [29—32]. Так, использование ВПО снижает частоту интубации только по сравнению с традиционной оксигенотерапией, при этом степень комфорта пациентов при ВПО выше, чем при традиционной кислородотерапии и при НИВЛ [29]. Интересно отметить, что даже в тех исследованиях, в которых на фоне применения ВПО не получено статистически значимого снижения частоты интубации трахеи, авторы отмечают безопасность ВПО. Так, R. Parke и соавт. показали, что подавляющее большинство пациентов из группы ВПО хорошо переносили эту методику [22].
В настоящее время нет однозначного мнения относительно оптимального алгоритма выбора первичных настроек ВПО и последующей их коррекции у больных с дыхательной недостаточностью различного генеза. Рабочий алгоритм коррекции гипоксемии с использованием ВПО представлен на рис. 2. Рис. 2. Коррекция гипоксемии с использованием высокопоточной оксигенации (модифицировано из статьи Т. Renda и соавт. [29]).
Рабочий алгоритм коррекции гипоксемии с использованием ВПО представлен на рис. 2. Рис. 2. Коррекция гипоксемии с использованием высокопоточной оксигенации (модифицировано из статьи Т. Renda и соавт. [29]).
Как указано выше, аппараты для ВПО имеют простой и информативный интерфейс, при этом врач при проведении ВПО корректирует только три параметра: температуру, скорость потока и фракцию вдыхаемого кислорода (рис. 3). Рис. 3. Схема проведения высокопоточной оксигенации.
На данный момент нет четких рекомендаций по выбору температуры для согревания кислородно-воздушной смеси. В то же время показано, что применение более низкой температуры (31—34 °С) ассоциируется с большим комфортом для пациентов с ОРДС по сравнению с температурой 37 °C [33]. В любом случае подбор температуры носит строго индивидуальный характер, с учетом ощущений конкретного пациента.
Что касается устанавливаемой скорости потока, продемонстрировано, что в подгруппе пациентов с выраженной дыхательной недостаточностью больные лучше переносили максимальный поток 60 л/мин, при этом пациенты с ОРДС легкой степени не испытывали дискомфорта и при более низком потоке [33].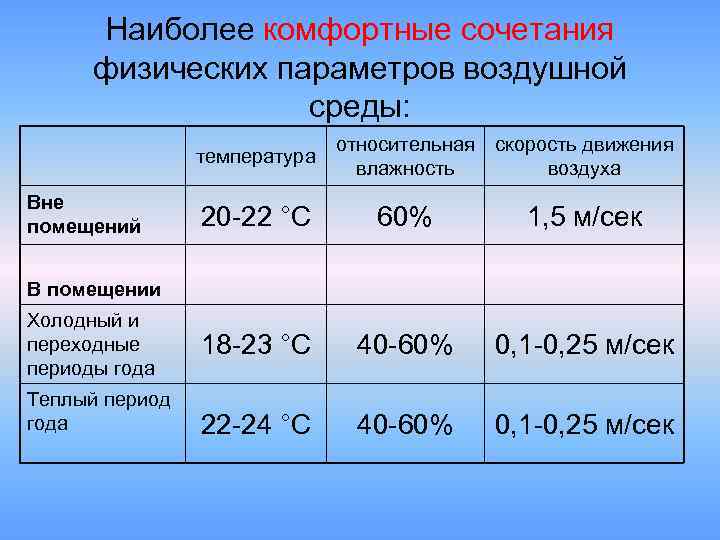
Таким образом, при ОРДС легкой степени тяжести допустимо начинать ВПО со скорости потока 20—30 л/мин с последующим увеличением последней в зависимости от показателей газообмена и состояния больного. В то же время у пациентов с более выраженной гипоксемией, вероятно, стоит начинать процедуру с более высоких цифр потока (50—60 л/мин) для развития максимального эффекта ПДКВ [34].
При выборе оптимальной фракции вдыхаемого кислорода у пациентов с ОРДС необходимо учитывать потенциальный вред от применения высокой концентрации кислорода, при этом следует подбирать минимальные значения, необходимые для достижения уровня SpO2 92—97% [27, 35]. Адекватной оксигенации следует добиваться прежде всего за счет увеличения скорости потока, а не фракции вдыхаемого кислорода. Подбор этих двух переменных должен строиться на принципах подбора ПДКВ и FiO2, описанных в рамках концепции респираторной поддержки у пациентов с ОРДС [5, 7, 27].
Ключевые принципы отлучения от ВПО аналогичны таковым при прекращении ИВЛ и подразумевают снижение FiO2 в условиях комплексного мониторинга оксигенации, постепенное снижение скорости потока кислородно-воздушной смеси на 5 л/мин каждые 6—8 часов; переход на традиционную кислородотерапию или спонтанное дыхание при скорости потока, равной или менее 20 л/мин, и FiO2менее 0,4 при адекватных показателях газообмена и в отсутствие признаков нарастания дыхательной недостаточности (см. рис. 2) [29].
рис. 2) [29].
Использование ВПО в ходе индукции анестезии у пациентов с ОРДС
В случае неэффективности стартовой консервативной терапии пациентам с ОРДС требуется обеспечение инвазивной вентиляции легких, при этом одним из критических моментов может стать сам процесс интубации трахеи с обеспечением седации и миорелаксации [36—40]. В этом плане перспективным видится направление по использованию ВПО на этапе преоксигенации. За счет поддержания высокого потока, возможности использования 100% кислорода, а также отсутствия необходимости прекращать оксигенацию во время ларингоскопии риск десатурации может быть минимизирован [41].
В настоящее время лишь в нескольких исследованиях проведено сравнение эффективности преоксигенации при помощи ВПО и лицевой маски у пациентов с гипоксемической дыхательной недостаточностью. Так, в исследовании М. Simon и соавт. у пациентов группы традиционной преоксигенации через минуту после индукции анестезии при переводе на ИВЛ у больных с гипоксемией наблюдалась более выраженная десатурация, чем у пациентов группы ВПО, у которых период ларингоскопии и интубации прошел без выраженного снижения уровня SpO2 [40].
В то же время ряд авторов уже продемонстрировали эффективность ВПО для преоксигенации у пациентов с интактными легкими. Так, А. Patel и S. Nourei показали, что преоксигенация при помощи ВПО позволяла избежать снижения уровня SpO2 менее 90%, несмотря на апноэ средней продолжительностью 17 мин [42]. Кроме того, применение ВПО во время экстренной интубации у пациентов ОИТ без признаков значимой гипоксемии (PaO2/FiO2 более 200 мм рт.ст.) ассоциируется с меньшей частотой десатурации (менее 90%), а также с меньшей частотой осложнений в ходе выполнения интубации трахеи [29].
Применение ВПО в период прекращения ИВЛ при ОРДС
Этап прекращения респираторной поддержки остается одним из ключевых аспектов ведения пациентов с ОРДС. Несмотря на улучшение состояния пациента и разрешающуюся дыхательную недостаточность, на этом этапе возможно развитие эпизодов гипоксемии и/или гиперкапнии, не менее клинически значимых, чем при манифестации ОРДС. В этих обстоятельствах нередко возникает потребность в реинтубации трахеи и продолжении инвазивной ИВЛ, особенно у пациентов высокого риска. Потребность в реинтубации остается серьезной проблемой отлучения от ИВЛ, встречающейся в 10—20% случаев ОРДС [43], и ассоциируется с ростом количества осложнений и повышением летальности (до 50% при необходимости реинтубации) [36]. В связи с этим, как показано в недавних исследованиях развития гипоксемической дыхательной недостаточности, в том числе у послеоперационных больных, необходимость поддержания адекватного газообмена после прекращения ИВЛ на фоне сохраняющейся гипергидратации легких требует дальнейшего поиска мер терапии, включая использование ВПО [30, 44].
В этих обстоятельствах нередко возникает потребность в реинтубации трахеи и продолжении инвазивной ИВЛ, особенно у пациентов высокого риска. Потребность в реинтубации остается серьезной проблемой отлучения от ИВЛ, встречающейся в 10—20% случаев ОРДС [43], и ассоциируется с ростом количества осложнений и повышением летальности (до 50% при необходимости реинтубации) [36]. В связи с этим, как показано в недавних исследованиях развития гипоксемической дыхательной недостаточности, в том числе у послеоперационных больных, необходимость поддержания адекватного газообмена после прекращения ИВЛ на фоне сохраняющейся гипергидратации легких требует дальнейшего поиска мер терапии, включая использование ВПО [30, 44].
В последнее время опубликован ряд работ, посвященных методам респираторной поддержки в постэкстубационном периоде. К таким методам относятся ВПО, НИВЛ и традиционная оксигенотерапия [34]. В недавнем рандомизированном исследовании G. Hernаndez и соавт. продемонстрировали, что применение ВПО по сравнению с традиционной оксигенотерапией способно снизить риск повторного перевода на ИВЛ у пациентов с клиникой дыхательной недостаточности в постэкстубационном периоде (4,9% по сравнению с 12,2%, р=0,004) [13].
Данное исследование включало широкий спектр пациентов с преобладанием больных хирургического профиля, с низким риском развития постэкстубационной острой дыхательной недостаточности. Более того, доля пациентов с ОРДС в этой работе невелика, что указывает на необходимость проведения дальнейших исследований. Эти же авторы оценили эффект ВПО по сравнению с НИВЛ у пациентов высокого риска в постэкстубационном периоде, показав схожее влияние обеих методик на частоту реинтубации при меньшем количестве осложнений, связанных с применением ВПО [45]. При этом одной из причин более выраженной гипоксемии у больных группы НИВЛ было раннее прекращение сеансов респираторной поддержки на фоне нарастающего дискомфорта у пациента [45].
S. Maggiore и соавт. в своем двуцентровом исследовании с участием пациентов смешанного профиля показали, что превентивное использование ВПО в раннем постэкстубационном периоде у больных с PaO2/FiO2 менее 300 мм рт.ст., находившихся на ИВЛ не менее 24 часов, сопровождается улучшением оксигенации, уменьшением дискомфорта, а также снижением частоты реинтубации по сравнению с применением кислородной маски с клапаном Вентури [46]. Следует отметить, что в эту работу включены преимущественно пациенты с пневмонией и с травмой, что указывает на необходимость проведения дальнейших исследований у больных с ОРДС.
Следует отметить, что в эту работу включены преимущественно пациенты с пневмонией и с травмой, что указывает на необходимость проведения дальнейших исследований у больных с ОРДС.
После принятия решения о прекращении ИВЛ и экстубации целесообразно начинать ВПО с достаточно высокой скоростью потока газовой смеси (50—60 л/мин) с учетом индивидуальной переносимости. Фракция вдыхаемого кислорода также подбирается индивидуально для достижения адекватной оксигенации. При стабильном состоянии пациента показано постепенное снижение фракции вдыхаемого кислорода с последующим поэтапным снижением скорости потока кислородно-воздушной смеси (пошагово по 3—5 л/мин в течение 2—4 часов). В отсутствие признаков нарастания дыхательной недостаточности, а также при фракции вдыхаемого кислорода менее 40% и скорости потока не более 15—20 л/мин возможно прекращение ВПО [29].
Отсутствие эффекта от ВПО в раннем постэкстубационном периоде, как правило, является показанием для реинтубации и продолжения ИВЛ. Критерии повторного перевода на ИВЛ пациентов, получающих ВПО, не отличаются от стандартных. К ним относятся развитие тахипноэ, участие в акте дыхания вспомогательной мускулатуры, неспособность самостоятельно откашливать трахеальный секрет, уровень SpO2 менее 90%, а также нестабильность гемодинамики и ухудшение неврологического статуса [47].
Критерии повторного перевода на ИВЛ пациентов, получающих ВПО, не отличаются от стандартных. К ним относятся развитие тахипноэ, участие в акте дыхания вспомогательной мускулатуры, неспособность самостоятельно откашливать трахеальный секрет, уровень SpO2 менее 90%, а также нестабильность гемодинамики и ухудшение неврологического статуса [47].
Важным вопросом является и прекращение респираторной поддержки у пациентов с трахеостомой. Несмотря на снижение работы дыхания, риск инфекционных осложнений и невозможность в полной мере самостоятельно санировать мокроту усложняют их перевод на спонтанное дыхание.
Применение ВПО как переходного этапа между ИВЛ и спонтанным дыханием имеет определенные клинические перспективы, однако информация на эту тему ограничена и носит противоречивый характер.
Так, L. Corley и соавт., сравнивая эффекты высокопоточной и низкопоточной оксигенации у пациентов с трахеостомой и осложненным течением послеоперационного периода в кардиохирургии, отметили улучшение PaO2/FiO2 на фоне применения ВПО и связали это с возможностями более точного дозирования фракции вдыхаемого кислорода [19].
Напротив, Т. Stripoli и соавт. показали, что применение ВПО у больных с трахеостомой не имело существенных преимуществ по сравнению с традиционной кислородотерапией на этапе отлучения от респиратора [48]. Согласно данной работе, применение ВПО не сопровождалось улучшением нейрореспираторного драйва, снижением работы дыхания, а также улучшением газообмена по сравнению с пациентами контрольной группы.
Снижение преимуществ ВПО при дыхании через трахеостому может объясняться устранением одного из благоприятных эффектов методики при этом способе ее проведения — улучшения элиминации CO2 за счет вентиляции назофарингеального мертвого пространства. Ранее показано, что наличие трахеостомы само по себе позволяет снизить нейрореспираторный драйв на 30% за счет снижения сопротивления в дыхательных путях и анатомического мертвого пространства [49].
Учитывая физиологические предпосылки, а также результаты клинических исследований, можно заключить, что высокопоточная оксигенация через назальные канюли претендует на место важного компонента респираторной поддержки пациентов с легким и умеренным острым респираторным дистресс-синдромом. Применение этой методики обосновано не только на начальных этапах ведения пациентов с острым респираторным дистресс-синдромом, но и на стадии прекращения искусственной вентиляции легких. Требуется проведение дальнейших крупных многоцентровых исследований по применению высокопоточной оксигенации.
Применение этой методики обосновано не только на начальных этапах ведения пациентов с острым респираторным дистресс-синдромом, но и на стадии прекращения искусственной вентиляции легких. Требуется проведение дальнейших крупных многоцентровых исследований по применению высокопоточной оксигенации.
Финансирование. Грант Президента Р.Ф. НШ—3927.2018.7.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Ушаков А.А. — https://orcid.org/ 0000-0002-1437-7162
Смёткин A.A. — https://orcid.org/0000-0003-4133-4173
Фот Е.В. — https://orcid.org/0000-0003-0052-8086
Кузьков В.В. — https://orcid.org/0000-0002-8191-1185
Киров М.Ю. — https://orcid.org/0000-0002-4375-3374
Клинические рекомендации (сестринское дело): регулирование температуры
Примечание. Это руководство в настоящее время пересматривается.
Введение
Цель
Значение терминов
Температурные диапазоны
Оценка
Группы пациентов в группе риска
Управление
Особые соображения
Сопутствующие документы
Ссылки
Таблица доказательств
Ссылки
Введение
Регулирование температуры остается важным компонентом стационарной помощи всем новорожденным и педиатрическим пациентам. Температура тела за пределами нормы может свидетельствовать об основных патологических процессах или клиническом ухудшении и должна быть своевременно выявлена. Поддержание стабильной температуры тела в пределах нормы способствует оптимизации обменных процессов и функций организма. Таким образом, сведение к минимуму факторов окружающей среды в условиях стационара, которые могут привести к ненужным колебаниям температуры тела, также важно.
Цель
Для оказания помощи медицинским работникам в проведении надлежащей оценки и потенциального контроля температуры тела новорожденных и детей в Королевской детской больнице.
Определение терминов
- Нормотермия : Температура тела в пределах нормы.
Точные нормальные диапазоны температуры различаются у разных людей и могут зависеть от некоторых генетических и хронических заболеваний. Важно установить исходный уровень для отдельных пациентов, чтобы выявить аномальные отклонения температуры тела. - Пирексия : Повышенная температура тела из-за повышения заданной температуры тела. Обычно это вызвано инфекцией или воспалением. Пирексия также известна как лихорадка или лихорадочная реакция.
Некоторые причины лихорадки не требуют лечения, в то время как другие причины необходимо выявлять и лечить. - Гипертермия : Повышенная температура тела из-за нарушения терморегуляции. Это происходит, когда тело производит и/или поглощает больше тепла, чем может рассеять.
- Тепловой удар : проявление тяжелой гипертермии.
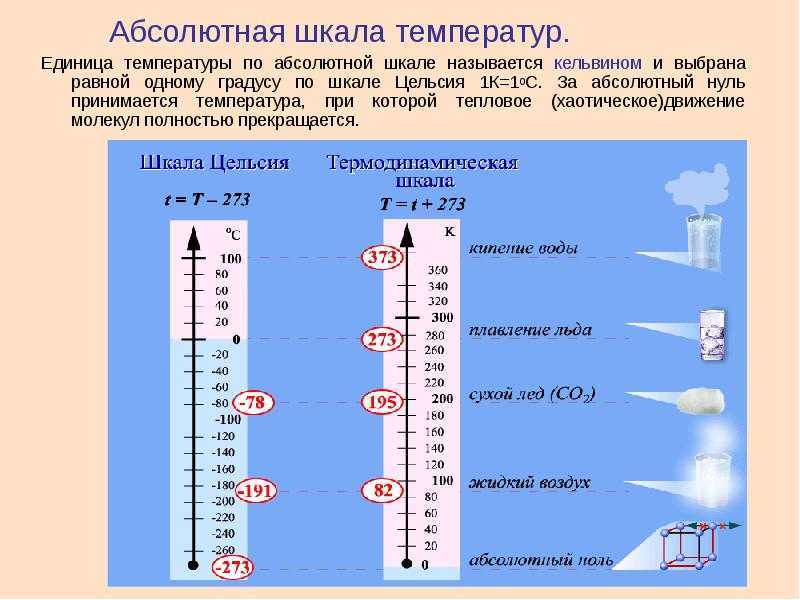 Терморегуляция нарушается из-за избыточной метаболической продукции и тепла окружающей среды в сочетании с нарушением теплоотдачи. Это редкость в условиях стационара.
Терморегуляция нарушается из-за избыточной метаболической продукции и тепла окружающей среды в сочетании с нарушением теплоотдачи. Это редкость в условиях стационара. - Низкая температура : Пониженная температура тела, при которой тело теряет тепло быстрее, чем может производить тепло.
- Гипотермия : Аномально низкая температура тела, при которой температура тела падает ниже безопасного уровня. Как низкие температуры, так и гипотермия могут быть вызваны факторами окружающей среды, метаболическими осложнениями, патологическими процессами или медикаментозно.
Диапазоны температур
| Классификация | Новорожденные | Педиатрия* |
| Низкотемпературный (или гипотермия) | <36,5⁰C | <36⁰C |
| Нормотермия | 36,5 — 37,5⁰С | 36–37,5⁰C |
| Субфебрильная лихорадка (или нормотермия) | 37,6 — 37,9⁰С | 37,6 — 37,9⁰C |
| Лихорадка (или гипертермия) | ≥ 38⁰С | ≥ 38⁰C |
*В современной литературе существуют значительные расхождения в предлагаемых значениях температуры и диапазонах. Значения, представленные в этой таблице, получены в результате сотрудничества нескольких источников и мнений экспертов и должны использоваться только в качестве ориентира. Точные нормальные диапазоны температур различаются у разных людей. Важно установить исходный уровень пациента, чтобы выявить аномальные отклонения температуры тела и оценить их в контексте других показателей жизнедеятельности и общего состояния пациента.
Значения, представленные в этой таблице, получены в результате сотрудничества нескольких источников и мнений экспертов и должны использоваться только в качестве ориентира. Точные нормальные диапазоны температур различаются у разных людей. Важно установить исходный уровень пациента, чтобы выявить аномальные отклонения температуры тела и оценить их в контексте других показателей жизнедеятельности и общего состояния пациента.
Пожалуйста, обратите внимание, что любой лихорадящий ребенок, который выглядит серьезно больным, должен пройти тщательное обследование и уведомить лечащую медицинскую бригаду, независимо от степени лихорадки.
У младенцев
<3 месяцев, гипотермия или нестабильность температуры могут быть признаками серьезного заболевания.
Оценка
Температуру тела следует измерять при поступлении и каждые четыре часа вместе с другими жизненно важными показателями, если клинически не показано более частое измерение.
Температуру тела, выходящую за пределы нормального диапазона, следует контролировать и при необходимости дополнительно контролировать до тех пор, пока не будет достигнута нормотермия.
При оценке температуры тела важно учитывать факторы, связанные с пациентом и окружающей средой, включая предшествующее введение жаропонижающих средств и недавнее воздействие окружающей среды.
Температуру тела всегда следует оценивать в контексте других показателей жизнедеятельности и общего состояния пациента.
Методы измерения температуры тела:
Из-за разницы температур между участками тела в идеале для постоянного наблюдения за пациентом следует использовать один и тот же маршрут, чтобы обеспечить точную оценку тренда температуры. Задокументируйте маршрут, используемый в EMR.
0-3 месяца: подмышечный путь
Подмышечный цифровой термометр в большинстве случаев является предпочтительным методом для этой возрастной группы.
Процедура:
- Поместите наконечник термометра в центр подмышечной впадины над подмышечной артерией, убедившись, что кожа сухая и неповрежденная перед размещением датчика.

- Надежно прижмите руку пациента к телу.
- Включите термометр. Для получения более точных показаний подождите > 3 минут с установленным термометром перед измерением.
0–3 месяца: ректальный путь (по запросу)
В особых случаях может потребоваться измерение ректальной температуры для более точной оценки температуры тела.
Это должно выполняться только с разрешения медицинского персонала при участии ANUM.
Следует избегать ректальных измерений в онкологической популяции и у пациентов с низким уровнем тромбоцитов, коагулопатией или травмами промежности и хирургическими вмешательствами в области малого таза из-за повышенного риска перфорации кишечника.
Процедура:
- Наденьте пластиковый чехол на термометр.
- Нанесите небольшое количество смазки на конец термометра.

- Осторожно введите термометр на 2 см в задний проход ребенка (на 1 см для недоношенных детей). Чрезмерное введение может вызвать перфорацию кишечника.
- Включите термометр.
- Подождите 5 секунд после того, как начнет мигать знак Цельсия, прежде чем начать запись.
- Снимите и очистите термометр спиртом.
>3 месяцев: барабанная трубка
Барабанная термометрия является предпочтительным методом для этой возрастной группы.
Процедура:
- Аккуратно вставьте зонд в слуховой проход, пока канал не будет полностью перекрыт, убедившись, что наконечник обращен к барабанной перепонке.
- Нажмите кнопку термометра и дождитесь звуковых сигналов.
- Если уши закрыты (например, наушники/шапочка), снимите их и подождите, пока слуховой проход не остынет, прежде чем проводить измерения.
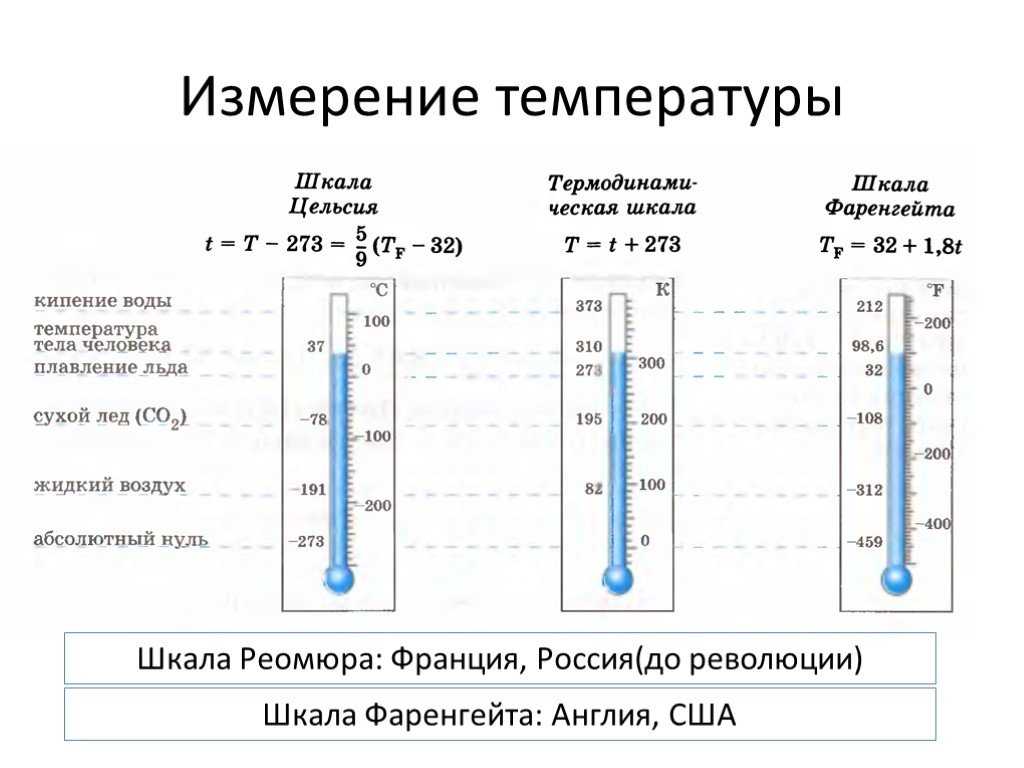 Если слуховые проходы пациента слишком малы для правильного введения барабанного зонда, рассмотрите возможность использования подмышечного термометра.
Если слуховые проходы пациента слишком малы для правильного введения барабанного зонда, рассмотрите возможность использования подмышечного термометра.
Примечания:
Если пациент находился на холоде, перед измерением температуры тела дайте пациенту достаточно времени, чтобы прийти в равновесие с комнатной температурой.
И подмышечный, и барабанный пути измеряют температуру ниже, чем истинная внутренняя температура тела.
Частота измерения температуры может различаться в специализированных областях, например, в отделении неотложной помощи, интенсивной терапии и периоперационных областях. Дополнительную информацию см. в руководствах конкретных отделений.
Группы пациентов с риском
Следующие группы пациентов подвержены повышенному риску невозможности поддержания нормотермии:
- Новорожденные и дети раннего возраста
- Пери- и послеоперационные пациенты
- Ожоговые больные
- Пациенты с травмами
- Пациенты с неврологическими нарушениями
Управление
Превентивные подходы
Окружающая среда пациента может сильно повлиять на его способность поддерживать в остальном стабильную температуру тела. Признание и минимизация влияния окружающей среды на терморегуляцию важно для всех педиатрических пациентов, особенно для новорожденных и групп риска.
Признание и минимизация влияния окружающей среды на терморегуляцию важно для всех педиатрических пациентов, особенно для новорожденных и групп риска.
В таблице ниже представлены подходы, которые медсестры, врачи и семьи могут использовать для минимизации предотвратимой передачи тепла от пациентов к окружающей среде.
| Режим | Определение | Клинические Сценарий | Профилактика Управление |
| Испарение | Потери тепла при превращении жидкости в пар | Потливость, недержание мочи Влажные или сочащиеся повязки | Держите пациента сухим Снять мокрую одежду, при необходимости заменить влажные повязки |
| Конвекция | Перенос тепла с поверхности тела в окружающий воздух воздушным потоком | Сквозняки в помещении | Переместите пациента подальше от сквозняков, закройте дверь |
| Проводник | Передача тепла от одного твердого объекта к другому твердому объекту при прямом контакте | Холодные одеяла, холодные весы | Накройте холодные поверхности подогретым полотенцем или одеялом |
| Излучение | Передача тепла более холодным твердым предметам, не находящимся в прямом контакте с телом | Ближайшие холодные окна или стены | Переместите пациента подальше от холодных поверхностей Закройте жалюзи на окне |
Ведение новорожденных
Педиатрическое управление
Примечания:
- Сепсис : Раннее распознавание и начальное лечение сепсиса у новорожденных и детей имеют первостепенное значение, и если его не лечить, это может привести к тяжелым заболеваниям и смертности.
 Для получения дополнительной информации о распознавании сепсиса и лечении новорожденных и педиатрии см. *Ссылка:
Для получения дополнительной информации о распознавании сепсиса и лечении новорожденных и педиатрии см. *Ссылка:
SEPSIS- оценка и лечение, RCH CPG* - Устройства Bair Hugger : При использовании устройства для принудительного обогрева воздуха температура устройства не должна устанавливаться выше 32⁰C в условиях стационара. Температуру пациента следует измерять повторно как минимум каждые 30 минут или если пациент
<6 месяцев, минимум каждые 15 минут при использовании принудительного обогрева воздуха, так как существует риск перегрева пациентов. Убедитесь, что одеяло правильно подсоединено к устройству, так как существует риск ожогов пациентов.
- Если применимо, обратитесь к руководствам отдельных отделений по ведению конкретных групп пациентов, например. Путь фебрильной нейтропении. См. раздел «Особые соображения» ниже.
Особые соображения
Следующие группы пациентов могут нуждаться в более специфических вмешательствах и/или различном лечении, когда температура тела выходит за пределы традиционно нормальных значений:
- Пациенты с фебрильной нейтропенией
- пациентов с терапевтическими гипотермическими
- Терапевтические гипотермические новорожденные
- пациенты с хроническими состояниями, вызывая более низкую базовую температуру тела
. Некоторые покровители пациентов имеют условия, которые влияют на их базовые металлургические показатели, и, таким образом, уникальные температуры и, таким образом, уникальные температуры, и, таким образом, уникальные температуры, и, таким образом, уникальные температуры. диапазоны. Важно установить нормальные колебания температуры у этих людей, чтобы выявить аномальные показания и принять соответствующие меры.
Некоторые покровители пациентов имеют условия, которые влияют на их базовые металлургические показатели, и, таким образом, уникальные температуры и, таким образом, уникальные температуры, и, таким образом, уникальные температуры, и, таким образом, уникальные температуры. диапазоны. Важно установить нормальные колебания температуры у этих людей, чтобы выявить аномальные показания и принять соответствующие меры. - Периоперационные и послеоперационные пациенты
- Перед операцией
- Убедитесь, что при поступлении измеряется температура, а пациенты надлежащим образом одеты и согреты перед операцией.
- При необходимости предоставьте теплое одеяло.
- Рассмотрите принудительное согревание воздухом (Bair Hugger) для пациентов, перенесших обширную хирургическую операцию.
- Выздоровление
- Обеспечить измерение температуры при поступлении в PACU
- Инициировать активное согревание с помощью принудительного согревания воздухом (Bair Hugger), если температура новорожденного пациента
<36⁰C (если не в штате Огайо/Изолетт) или температура у педиатрического пациента <35,5⁰C.
- Во время активного согревания пациента следует измерять температуру каждые 5 минут.
- В случае перегрева или ожогов прекратите активное согревание и обратитесь к анестезиологу (лечащему или ответственному). Охладите пациента, если это необходимо. Задокументируйте событие через EMR и заполните VHIMS.
- Температура при выписке ≥36,6⁰C для новорожденных и ≥36⁰C для детей. Убедитесь, что клинические индикаторы завершены, а активные вмешательства по согреванию задокументированы в EMR.
- Пациенты с хроническими заболеваниями, вызывающими более низкую исходную температуру тела, должны вернуться к своему исходному уровню до перевода в палату. Эту исходную температуру следует обсудить с родителями/опекунами и сообщить в приемное отделение или дневной стационар.
- Если послеоперационная температура
<36⁰C, но ≥35,5⁰C, больной в сознании, все остальные жизненные показатели стабильны и в пределах нормы, их можно перевести в палату. По клиническим показаниям можно обеспечить принудительное обогрев воздуха в палате для дальнейшего использования. Это следует обсудить с родителями/опекунами и сообщить в приемное отделение.
По клиническим показаниям можно обеспечить принудительное обогрев воздуха в палате для дальнейшего использования. Это следует обсудить с родителями/опекунами и сообщить в приемное отделение.
- Обеспечить измерение температуры при поступлении в PACU
- Перед операцией
Сопроводительные документы
- Оценка медсестер (CPG (сестринское дело))
https://www.rch.org.au/rchcpg/hospital_clinical_guideline_index/Nursing_assessment/ - Лихорадящий ребенок (CPG на уровне штата):
https://www.rch.org.au/clinicalguide/guideline_index/febrile_child/ - SEPSIS (CPG на уровне штата):
https://www.rch.org.au/clinicalguide/guideline_index/SEPSIS_assessment_and_management/ - Фебрильная нейтропения (CPG по всему штату):
https://www.rch.org.au/clinicalguide/guideline_index/Fever_and_suspected_or_confirmed_neutropenia/
Дополнительные полезные ссылки
Информационный бюллетень RCH Kids Health о лихорадке у детей
https://www.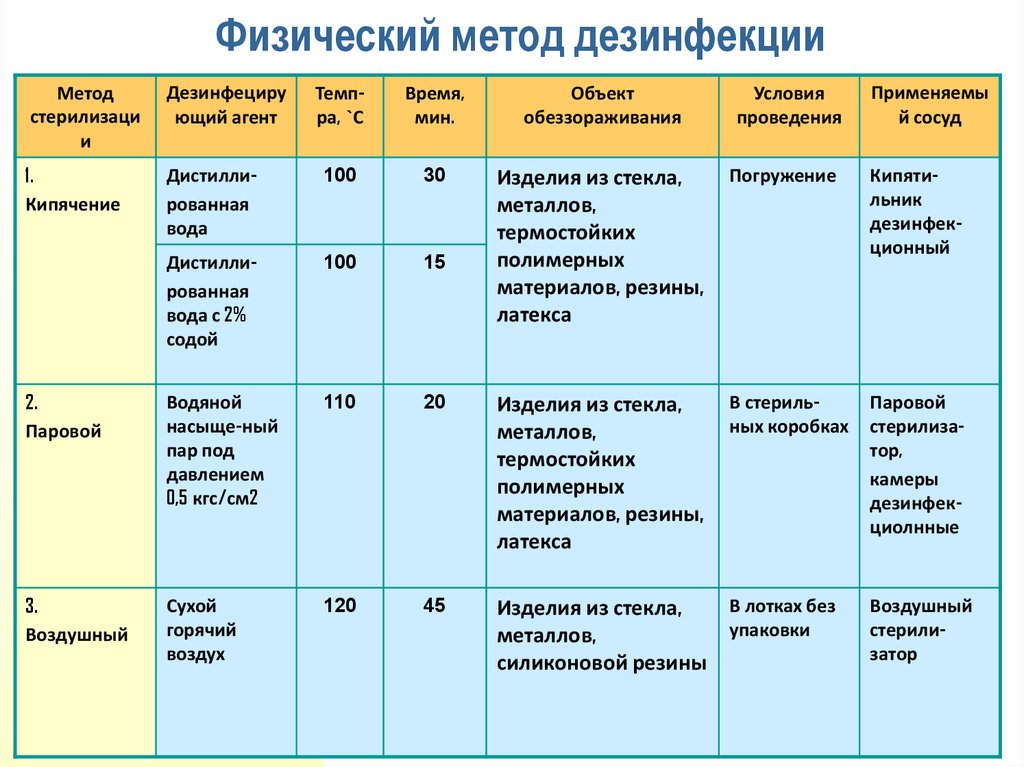 rch.org.au/kidsinfo/fact_sheets/fever_in_children/
rch.org.au/kidsinfo/fact_sheets/fever_in_children/
Таблица доказательств
Таблица фактических данных руководства по уходу за пациентами с температурным контролем, 2019 г.
Ссылки
- Asher, C., & Northington, L.K. (2008). Заявление о положении для измерения температуры/лихорадки у детей. Журнал педиатрического ухода, 23 (3), 234-236. doi: 10.1016/j.pedn.2008.03.005
- Барби Э., Марзуилло П., Нери Э., Навильо С. и Краусс Б. С. (2017). Лихорадка у детей: жемчужины и ловушки. Дети, 4(9), 81-99. дои: 10.3390/дети40
- Бхарти, П., Чаухан, М., и Ахмед, К. (2017). Сравнение ректальной, инфракрасной барабанной и инфракрасной температуры кожи у доношенных новорожденных. Международный архив комплексной медицины, 4(3), 43-49. Получено с https://search-ebscohost-com.ezp.lib.
 unimelb.edu.au/login.aspx?direct=true&db=a9h&AN=122002190&site=eds-live&scope=сайт
unimelb.edu.au/login.aspx?direct=true&db=a9h&AN=122002190&site=eds-live&scope=сайт - Дэви, А., и Амур, Дж. (2010). Передовая практика измерения температуры тела. Стандарт сестринского дела, 24(42), 42-49. дои: 10.7748/ns2010.06.24.42.42.c7850
- Дериг, С. (2017). Обзор периоперационного ухода за педиатрическими пациентами. Журнал периоперационного ухода в Австралии, 30 (3), 23–29. дои: 10.26550/303/23-29
- Догерти, Л., Листер, С., и Вест-Орам, А. (2015). Наблюдения. В Королевском руководстве Марсдена по клиническим сестринским процедурам, 9-е изд. (стр. 534-540). Западный Сассекс, Великобритания: Фонд Royal Marsden NHS Foundation Trust.
- Эль-Радхи А.С. (2018). Измерение температуры тела. В Эль-Радхи А. (ред.) Клиническое руководство по лихорадке у детей (стр. 69-84). Получено с https://doi.org/10.1007/978-3-319-92336-9_4
- Freer, Y.
 , & Lyon, A. Мониторинг и контроль температуры у новорожденного. (2011). Педиатрия и здоровье детей, 22(4), 127-130. doi:10.1016/j.paed.2011.09.002
, & Lyon, A. Мониторинг и контроль температуры у новорожденного. (2011). Педиатрия и здоровье детей, 22(4), 127-130. doi:10.1016/j.paed.2011.09.002 - Хэй, А. Д., Костелло, К., Редмонд, Н. М., Монтгомери, А. А., Флетчер, М., Холлингхерст, С., и Питерс, Т. Дж. (2008). Парацетамол плюс ибупрофен для лечения лихорадки у детей (PITCH): рандомизированное контролируемое исследование. Британский медицинский журнал, 337 (7672), 729.-733. дои: 10.1136/bmj.a1302
- Ишлер, А., Айдын, Р., Гювен, Ш. Т. и Гюнай С. (2014). Сравнение височной артерии с ртутным и цифровым измерением температуры в педиатрии. Международная неотложная медицинская помощь, 22(3), 165-168. doi:10.1016/j.ienj.2013.09.003
- Кнобель, Р. Б. (2014). Тепловая физиология плода и новорожденного. Обзоры ухода за новорожденными и младенцами, 14 (2), 45–49.. doi: 10.1053/j.nainr.2014.03.003
- Ледук, Д.
 Вудс, С. (2013). Заявление о позиции: измерение температуры в педиатрии. Канадское педиатрическое общество. Получено с https://www.cps.ca/en/documents
Вудс, С. (2013). Заявление о позиции: измерение температуры в педиатрии. Канадское педиатрическое общество. Получено с https://www.cps.ca/en/documents - Национальный институт здравоохранения и клинического мастерства (NICE). (2013). Лихорадочное заболевание у детей: оценка и начальное лечение у детей младше 5 лет. Лондон: Королевский колледж акушеров и гинекологов. Получено с https://www.nice.org.uk/guidance/cg160
- Огуз Ф., Йылдыз И., Варкал М.А., Хизли З., Топрак С., Каймакчи К., … Унувар Э. (2018). Подмышечная и тимпанальная температура у детей и возрастные нормы. Педиатрическая неотложная помощь, 34(3), 169-173. doi:10.1097/PEC.0000000000000693
- Принц, В., Хоббс, А.М., Тойтен, П., и Пол, С.П. (2016). Клинические обновления: оценка и лечение детей с лихорадкой. Общественный деятель, 89 лет(6), 32-37.
- Тревизануто, Д.
 , Тестони, Д., и де Алмейда, М. Ф. (2018). Поддержание нормотермии: зачем и как? Семинары по фетальной и неонатальной медицине, 23(5), 333-339. doi:10.1016/j.siny.2018.03.009
, Тестони, Д., и де Алмейда, М. Ф. (2018). Поддержание нормотермии: зачем и как? Семинары по фетальной и неонатальной медицине, 23(5), 333-339. doi:10.1016/j.siny.2018.03.009 - Вайс, С.Л., и Померанц, В.Дж. (2019). Септический шок у детей: быстрое распознавание и начальная реанимация (первый час). Своевременно. Получено с https://www.uptodate.com/contents/septic-shock-in-children-rapid-recognition-and-initial-resuscitation-first-hour
Пожалуйста, не забудьте прочитать
отказ от ответственности.
Разработка этого руководства по сестринскому делу координировалась Элизабет Кук, RN, ED, и была одобрена Комитетом по клинической эффективности сестринского дела. Обновлено в августе 2019 г.
Лихорадка Температура: точность и сравнение – Библиотека медицинской информации
Поиск
Идти
Измерение температуры вашего ребенка
Обзор темы
Температуру можно измерять через рот (орально), анус (ректально), подмышку (аксиллярно) или ухо (барабанно). Но показания температуры различаются в зависимости от того, какой из них вы используете, и вам нужна точная температура тела, чтобы определить, присутствует ли лихорадка.
Но показания температуры различаются в зависимости от того, какой из них вы используете, и вам нужна точная температура тела, чтобы определить, присутствует ли лихорадка.
Медицинские исследования не выявили точной корреляции между оральными, ректальными, ушными, подмышечными и лобными измерениями температуры. Как правило, корреляция температурных результатов выглядит следующим образом:
- Средняя нормальная температура полости рта составляет 98,6°F (37°C).
- Ректальная температура на 0,5°F (0,3°C) — 1°F (0,6°C) выше, чем оральная температура.
- Ушная (барабанная) температура на 0,5°F (0,3°C) — 1°F (0,6°C) выше, чем оральная температура.
- Подмышечная (подмышечная) температура обычно на 0,5°F (0,3°C) — 1°F (0,6°C) ниже, чем оральная температура.
- Сканер лба (височный) обычно на 0,5°F (0,3°C)–1°F (0,6°C) ниже, чем оральная температура.

Важно помнить:
- Считается, что ректальная температура наиболее точна для измерения температуры у маленьких детей.
- Производитель используемого вами термометра, например ушного или налобного термометра, предоставляет информацию о том, как его использовать. Обязательно прочитайте и следуйте инструкциям, чтобы получить точную температуру. Информация может также включать в себя то, как результаты устройства коррелируют с результатами других методов измерения температуры.
- Термометры с пластиковыми полосками имеют некоторые применения, но не рекомендуются для обычного домашнего использования. В отличие от оральных, ректальных и ушных термометров, термометры с пластиковой полоской измеряют температуру кожи, а не температуру тела.
Когда вы говорите со своим врачом о температуре, обязательно сообщите, какой метод использовался для измерения температуры.
Таблица сравнения температур
В приведенной ниже таблице сравнения температур указан диапазон корреляции температуры с различными методами, используемыми для измерения температуры. Информацию о точном измерении температуры у младенцев и детей см. в разделе Температура тела.
Для использования таблицы:
- Найдите метод, который вы использовали для измерения температуры.
- Найдите правильный диапазон температур.
- Найдите температурный диапазон других методов, соответствующий используемому вами методу. Например:
- Если температура полости рта вашего 2-летнего ребенка составляет 101°F (38,3°C), его или ее ректальная или ушная температура может быть около 102°F (38,9°C). Помните, что у ребенка жар, когда его или ее температура составляет 100,4 ° F (38 ° C) или выше, измеренная ректально.

- Если ваша подмышечная температура составляет 100°F (37,8°C), температура полости рта составляет около 101°F (38,3°C).
- Если температура полости рта вашего 2-летнего ребенка составляет 101°F (38,3°C), его или ее ректальная или ушная температура может быть около 102°F (38,9°C). Помните, что у ребенка жар, когда его или ее температура составляет 100,4 ° F (38 ° C) или выше, измеренная ректально.
Подмышечная область/лоб (°F) | Оральный (°F) | Ректально/ухо (°F) |
|---|---|---|
98,4–99,3 | 99,5–99,9 | 100,4–101 |
99,4–101,1 | 100–101,5 | 101,1–102,4 |
101,2–102 | 101,6–102,4 | 102,5–103,5 |
102,1–103,1 | 102,5–103,5 | 103,6–104,6 |
103,2–104 | 103,6–104,6 | 104,7–105,6 |
Подмышечная область/лоб (°C) | Оральный (°C) | Ректально/ухо (°C) |
|---|---|---|
36,9–37,4 | 37,5–37,7 | 38–38,3 |
37,5–38,4 | 37,8–38,5 | 38,4–39,1 |
38,5–38,9 | 38,6–39,1 | 39,2–39. |

Всего комментариев: 0